
| A. | Q1+3Q2>6Q3 | B. | Q1+3Q2<6Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
分析 已知N2和H2合成氨的反应是放热反应,该反应放热,△H<0,根据反应热△H=反应物的总键能-生成物的总键来计算该反应的反应热,据此解答.
解答 解:破坏1mol N≡N键消耗的能量为Q1kJ,则N≡N键能为Q1kJ/mol,
破坏1mol H-H键消耗的能量为Q2kJ,则H-H键键能为Q2kJ/mol,
形成1molH-N键释放的能量为Q3kJ,则H-N键能为Q3kJ/mol,
对于3H2(g)+N2(g)═2NH3(g),反应热△H=反应物的总键能-生成物的总键能,
故:反应热△H=3Q2kJ/mol+Q1kJ/mol-6Q3kJ/mol=(3Q2+Q1-6Q3)KJ/mol,
反应热△H<0,即(3Q2+Q1-6Q3)<0,
所以3Q2+Q1<6Q3,
故选:B.
点评 本题考查反应热的计算,注意把握从键能的角度计算反应热的方法,放热△H<0是解答的关键点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属锂作电池的负极,石墨作电池的正极 | |
| B. | 电解质溶液中不能混入水,必须与空气隔绝 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出的硫物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
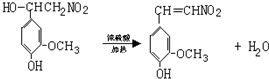
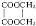 +2H2O,反应类型是酯化反应.
+2H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
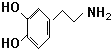
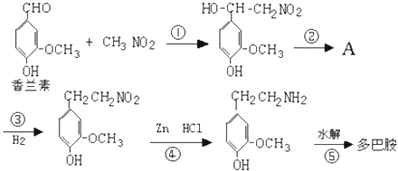
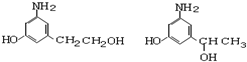 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
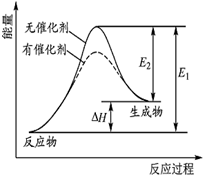 某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变 | |
| C. | 催化剂不能降低反应的活化能 | |
| D. | 逆反应的活化能小于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | W、X、Y三种元素最低价氢化物的稳定性依次降低 | |
| B. | X、Z、W的最高价氧化物对应的水化物酸性最强的是X | |
| C. | 五种元素均为非金属元素 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com