
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:不详 题型:实验题
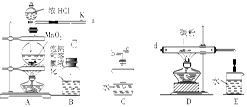
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将NaHCO3固体加入新制氯水中,有无色气泡产生(H+) |
| B.使红色布条褪色(HCl) |
| C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
| D.滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 次数 | 1 | 2 | 3 |
| 滴定体积(mL) | 19.60 | 19.65 | 19.55 |
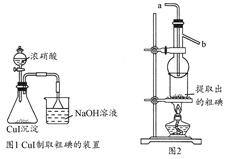
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
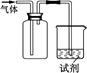
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2、H2、HCl、HBr | B.Cl2、HCl、HBr、H2 |
| C.Cl2、HBr、H2、HCl | D.Cl2、HBr、HCl、H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
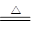 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
查看答案和解析>>
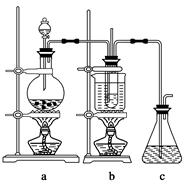
科目:高中化学 来源:不详 题型:单选题
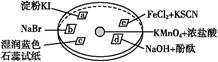
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
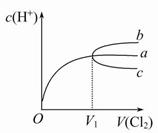
| A.将饱和氯水升温,继续通入Cl2时,溶液中c(H+)变化如曲线b |
| B.在饱和氯水中通入SO2气体,溶液中c(H+)变化如曲线c |
| C.降温,继续通入Cl2时,溶液中c(H+)的变化曲线如b |
| D.在饱和氯水中加入NaOH使pH=7,所得溶液中存在c(Na+)>c(ClO-)>c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com