
【题目】向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A.氯气:K+、Na+、SiO32-、NO3- B.二氧化硫:Na+、NH4+、SO32-、Cl-
C.硫化氢:H+、K+、MnO4-、SO42- D.氨气:K+、Na+、AlO2-、CO32-
科目:高中化学 来源: 题型:
【题目】某可逆反应为2X(g) ![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:

下列推断正确的是
A.升高温度,该反应平衡常数K减小
B.压强大小为:P3>P2>P1
C.平衡后加入高效催化剂使Mr增大
D.在该条件下M点X平衡转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧生成,下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.等物质的量的O2和O3含有相同的质子数
D.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。

已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
(3)![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为______________。
(2) 中官能团的名称为____________________;
中官能团的名称为____________________;
(3)反应③的反应类型是___________;已知A为一氯代物,则E的结构简式是____________;
(4)反应④的化学方程式为_______________________;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有________种:①含有苯环;②既不能发生水解反应,也不能发生银镜反应;③1mol该有机物能与2molNaHCO3完全反应。
(6)请写出以A为原料制备![]() 的合成路线流程图 (无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图 (无机试剂任用)。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 不能说明氧的非金属性比硫强的事实是( )
A. H2O的热稳定性强于H2S
B. 硫化氢水溶液露置于空气中变浑浊
C. H2O是液体,H2S常温下是气体
D. 氧气和氢气化合比硫和氢气化合容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s) = CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol1则Q1、Q2的关系为
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分) 东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_ _,提供孤电子对的成键原子是__ ___。
③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是____ ;氨是____ _分子(填“极性”或“非极性”),中心原子的轨道杂化类型为____。
(3)单质铜及镍都是由______键形成的晶体:元素同与镍的第二电离能分别为:I(Cu)=1959kJ/mol,I(Ni)=1753kJ/mol,I(Cu)>I(Ni)的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
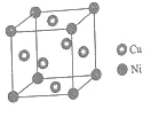
晶胞中铜原子与镍原子的数量比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。

下列有关说法正确的是
A .正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用比表示阿伏加德罗常数的数值,下列说法正确的是( )
A.ILlmol/L的氯化铁溶液中,若C1-的数目为3 NA,则Fe3+的数目为NA
B.1 molN2和3 molH2在一定条件下充分反应,转移电子数目为6NA
C.常温下,1L0.lmol/L的Na2S溶液中阴离子数目大于0.1 NA
D.0.1 mol Cl2通入水中,转移电子的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com