
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是 相同条件下N2的2倍.
(1)求该有机物的分子式 .
(2)该有机物链状同分异构体的结构简式为: 、 、 .
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 .
【答案】(1)C4H8;(2)CH2=CHCH2CH3,CH3CH=CH2CH3,![]() ;(3)
;(3)![]() 。
。
【解析】
试题分析:(1)根据元素守恒,n(C)=8.8/44mol=0.2mol,n(H)=3.6×2/18mol=0.4mol,其质量为m(C)=0.2×12g=2.4g,m(H)=0.4g,说明有机物中不含氧元素,其最简式为CH2,相对密度是氮气的2倍,有机物的相对分子量为2×28=56,因此有机物的分子式为C4H8;(2)属于链烃,以及有机物的分子式,推出属于烯烃,其结构简式可能为:CH2=CHCH2CH3,CH3CH=CH2CH3,![]() ;(3)只有一种峰,说明只有一种氢,烯烃和环烷烃互为同分异构体,则符合条件的结构简式为
;(3)只有一种峰,说明只有一种氢,烯烃和环烷烃互为同分异构体,则符合条件的结构简式为![]() 。
。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】【物质结构】硼是一种重要的非金属元素,在化学中有很重要的地位。
(1)基态硼原子电子排布图为 ,核外有 种运动状态不同的电子。
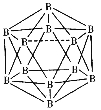
(2)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有 种不同的结构类型。
(3)无定形硼与Cl2反应得到BCl3,BCl3的空间构型为 。
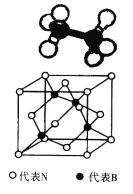
(4)氨硼烷是一种有效、安全的固体储氢材料。氨硼烷的结构和乙烷相似(如图),B、N原子的杂化轨道类型分别为 和 ,氨硼烷 (填“能”或“不能”)溶于水。
(5)立方氮化硼的结构与金刚石相似,其晶胞如图所示,则晶胞顶点上的原子的配位数为 。若晶胞的边长为a nm,则立方氮化硼的密度表达式为 g/cm3(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关1mol H2的说法中,不正确的是(NA表示阿伏加德罗常数)( )
A.质量为2g
B.含氢原子数为NA
C.含氢分子数为NA
D.在标准状况下,体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于
A. 由极性键构成的极性分子
B. 由极性键构成的非极性分子
C. 由非极性键构成的极性分子
D. 由非极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元索周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是
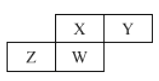
A.原子半径:Z>W>X>Y
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性 :Y>X>W>Z
D.元素X、Z、W、Y的最高化合价都分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是同周期元素基态原子的最外层电子排布式,所表示的原子最容易得到电子的是( )
A. ns2 B. ns2np1 C. ns2np4 D. ns2np5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:

已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是___________________。
(4) Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有__________,请写出工业上用氯气和消石灰生产漂粉精的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______ ,提供孤电子对的成键原子是_____。
③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
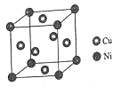
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com