
【题目】盐酸与大理石反应制备二氧化碳时,不能使反应速率明显加快的是
A.块状大理石敲碎B.盐酸的浓度增加一倍
C.盐酸的用量增加一倍D.温度升高10℃
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物E(分子式C8H7ClO)在有机合成中有重要应用,它能与氯化铁发生显色反应,分子中苯环上有两种氢原子,其工业合成途径如下: ![]()
(1)A的结构简式 , B中含有的官能团是 .
(2)反应①~④中,属于加成反应的是(填序号)
(3)写出步骤②反应方程式 , 其反应类型为 .
(4)E分子核磁共振氢谱有5组峰,峰面积之比为1:1:1:2:2. ①则E的结构简式为;
②E的同分异构体中含有苯环且能够发生银镜反应的物质有种,其中核磁共振氢谱有4组峰,峰面积之比为1:2:2:2,写出其结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程: 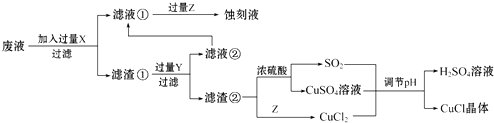
根据以上信息回答下列问题:
(1)生产过程中X的化学式为 .
(2)写出产生CuCl的化学方程式: .
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由 . 实际生产中SO2要适当过量,原因可能是(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为 , 当pH较大时CuCl产率变低原因是 . 调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是 .
(5)氯化亚铜的定量分析: ①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为(结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:肼(N2H4)是一种清洁高效的火箭燃料。 0.25 molN2H4(g)完全燃烧生成氮气和气态水时,放出 133.5 kJ 热量。该反应的热化学方程式:__________。若将上述等量N2H4气体完全燃烧生成氮气和液态水,则放出的热量_____ 133.5 kJ(填“<”、 “>” 或“=”)。
(2)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池(如图)是一种碱性燃料电池。

①电池中通入N2H4 的一极是______极(填“正”或“负”);
②写出该电池正极的电极反应:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的MgCl2溶液和AlCl3溶液中的Cl-浓度若相同,则可推知MgCl2和AlCl3溶液的物质的量浓度之比为
A.1∶1B.1∶2C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A和气体B的摩尔质量之比为4:1,则同温同压下,相同体积的A与B气体的分子数之比为( )
A. 4:1 B. 1:2 C. 1:1 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏低的是:( )
A. 定容时俯视容量瓶刻度线
B. 样品中含有少量Na2O杂质
C. 容量瓶使用前用NaOH溶液润洗
D. 在烧杯中溶解时,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C﹣NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nCNa(1﹣x)MO2+NaxCn , 下列有关该电池的说法正确的是( ) 
A.电池放电时,溶液中钠离子向负极移动
B.电池充电时的阳极反应式为:nC+x Na+﹣xe﹣═NaxCn
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少
D.该电池负极的电极反应为:NaMO2﹣xe﹣═Na(1﹣x)MO2+xNa+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com