
����Ŀ�������һζ�������в�ҩ�������ġ���ũ���ݾ�����������Ƶ�Ч�ã����з磬�˺�ͷʹ����ű������������ȥа������ֹ���������������ȣ���֢����ۡ���Ƶ���Ч�ɷ���Ƽ�(����F)�ж��ֺϳɷ������ϳɷ���֮һ��ͼ��ʾ����ش�������⡣
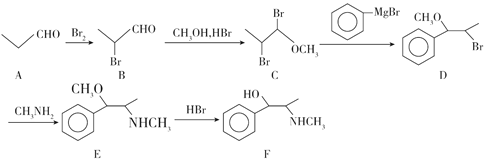
��1��C�к��еĹ�����������____��
��2��D��E�ķ�Ӧ������____��
��3��A������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ��____��
��4�����й�����Ƽ��˵���������_____(��ѡ�����)��
a����Ƽ������ᡢNaOH��Һ���ɷ�Ӧ
b����Ƽ���Է�����ȥ��ȡ�����ӳɷ�Ӧ
c����Ƽ��еĵ�ԭ�Ӻ�����̼ԭ�ӿ��ܹ���
��5����Ƽ��ͬ���칹��������������������____�֣����к˴Ź���������6����������ȡ����������������λ�õĽṹ��ʽ��___��
�ٱ�����������ȡ����������һ���� NH2��������FeCl3��Һ����ɫ��
��6��������Ҵ���![]() �Ʊ�������ĺϳ�·��____(���Լ���ѡ)��
�Ʊ�������ĺϳ�·��____(���Լ���ѡ)��
���𰸡���ԭ�ӡ��Ѽ� ȡ����Ӧ ![]() ��
��![]() ac 40
ac 40  C2H5OH
C2H5OH![]() C2H4
C2H4![]() C2H5Br
C2H5Br ��
��
C2H5OH![]() C2H5Br
C2H5Br
��������
��1�������������ͼ��C�Ľṹ��ʽ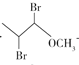 ��֪�����еĹ�������������ԭ�ӡ��Ѽ���
��֪�����еĹ�������������ԭ�ӡ��Ѽ���
��Ϊ����ԭ�ӡ��Ѽ���
��2��D��E�ķ�ӦΪ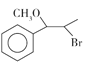
 ����D��E�Ľṹ�Ϸ�������Ӧ������D�е���ԭ�ӱ�-NHCH3ȡ������˷���ȡ����Ӧ��
����D��E�Ľṹ�Ϸ�������Ӧ������D�е���ԭ�ӱ�-NHCH3ȡ������˷���ȡ����Ӧ��
��Ϊ��ȡ����Ӧ��
��3������A�Ľṹ��ʽ��AΪ��ȩ��![]() ����������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ��
����������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ��![]() ��
��![]() ��
��
����![]() ��
��![]()
��4��a.��Ƽ��к����ǰ������ǻ����ܺ����ᷴӦ�����ܺ�NaOH��Һ��Ӧ��a����
b. ��Ƽ��к��б������ǻ��ȣ������ǻ����ڵ�̼ԭ���Ϻ�����ԭ�ӣ����Է�����ȥ��ȡ�����ӳɷ�Ӧ��b��ȷ��
c.![]() ��ͼ��Բ�α�ע��̼ԭ�Ӻ���֮����������̼ԭ�ӡ�һ����ԭ�Ӳ����ܹ��棬c����
��ͼ��Բ�α�ע��̼ԭ�Ӻ���֮����������̼ԭ�ӡ�һ����ԭ�Ӳ����ܹ��棬c����
����ac��
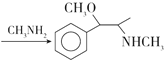
��5������Ҫ���֪�����ϵ�����ȡ�����ֱ��ǰ��������ǻ��Ͷ���������������������ͬ��ȡ����λ����10�֣����������ֽṹ���������Ҫ���ͬ���칹��Ϊ40�֣����к˴Ź���������6����������ȡ����������������λ�õĽṹ��ʽ�� ��
��
����40�� ��
��
��6�������ѧ����֪ʶ���Ҵ���![]() �Ʊ�������ĺϳ�·��Ϊ��C2H5OH
�Ʊ�������ĺϳ�·��Ϊ��C2H5OH![]()
![]() C2H5Br
C2H5Br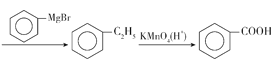
��C2H5OH![]() C2H5Br
C2H5Br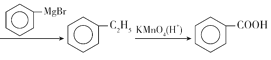 ��
��


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�ü�ҩƷ��ʵ����Ӧʵ��Ŀ�ĵ���

A. ��������ȡNaHCO3���� B. �����ڷ���I2��NH4Cl
C. ������֤���ǽ�����ǿ����Cl>C>Si D. �����ڲⶨijϡ��������ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����̬������һ����̬ϩ����ɵĻ���ﹲ0.1 mol����ȫȼ�յ�0.16 mol������̼��3.6 gˮ������˵����ȷ������ ��
A. һ���м��� B. һ���Ǽ������ϩ C. ���������� D. һ������Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�Ͻ���һ�ֳ��õı�������ϣ���ҵ�����л����һЩ����ָ��ﲻ��Ҫ��ĺϽ�Ϊ������Դ�˷ѿ������������̶Բ����Ͻ��е��ࡢͭ���л��գ���ش�������⡣
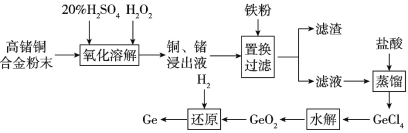
��1������Ԫ�����ڱ��е�λ����____��
��2�������ܽ������ͭ���뷴Ӧ�����ӷ���ʽ��___��Ϊ�ӿ������ܽⷴӦ���ʿɲ��õĴ�ʩ��___(��д����)��
��3�������ijɷ���_____��
��4��ˮ����̷����ķ�Ӧ��GeCl4+2H2O=GeO2��+4HCl��Ϊ�õ�������GeO2����ˮ�����û����Ҫ���й��ˡ�ϴ�ӡ�����Ȳ������ж�GeO2�Ƿ�ϴ�Ӹɾ��IJ�����__��
��5�����н�����ұ��ԭ�������������ұ��ԭ�����Ƶ���____(��ѡ�����)��
A���� B���� C���� D����
��6��������6.2���ĸ���ͭ�Ͻ������Ϊ50kg����ԭ�����в��뷴Ӧ��H2���Ϊ1.792m3(���ۺ�Ϊ��״��)������Ļ�����Ϊ____(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����480mL0.1mol��L-1Na2SO4��Һ���ش��������⡣
��1������Na2SO4��Һʱ���õ���Ҫ������������ƽ��ҩ�ס��ձ�����������___��___��
��2����������ƽ��ʮˮ�����ƣ�Na2SO4��10H2O������__g��
��3�����в�����������Һ��Ũ���к�Ӱ�죨�ƫ�ߡ�ƫ�ͻ���Ӱ�족��
A.���á���������ij��������Ƹþ���___
B.����ƿδ�����Tʹ��___
C.�ܽ��û����ȴ����ж���___
D.���ǽ�ϴ��Һת������ƿ___
E.����ʱ���ӿ̶��߶���___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������M�п��ܺ���Al2O3��Fe2O3��Al��Cu��Ϊȷ������ɣ�ijͬѧ�����ͼ��ʾ����������

���з�����ȷ����
A����m1>m2ʱ��������M��һ������Al2O3
B��������ɫ��Һ�����ӷ���ʽΪ��Cu+Fe3+=Cu2++Fe2+
C������B�ȿ���ʹ������ֿ����ǻ����
D��Ҫȷ�������M���Ƿ���Al����ȡM������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3��Һ�ı�����ȷ����
A. c (Na��)��c (HCO3��)��c (CO32��)��c (H2CO3)
B. c (Na��)��c (H��)��c (HCO3��)��c (CO32��)��c (OH��)
C. HCO3�� �ĵ���̶ȴ���HCO3����ˮ��̶�
D. ����뷽��ʽΪ��NaHCO3![]() Na����H����CO32��
Na����H����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2���䷴ӦΪ��2NO��2CO![]() 2CO2��N2�����賣�����ں��ݵ��ܱ������з���������Ӧ���Խ���������⣺
2CO2��N2�����賣�����ں��ݵ��ܱ������з���������Ӧ���Խ���������⣺
��1�����������¸÷�Ӧ�ܹ��Է����У���Ӧ����H_____0����д��������������������������
��2�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____________��
A����������ѹǿ���ֲ���
B��N2��Ũ�Ȳ��ٸı�
C������CO�����ʵ���������CO2�����ʵ���֮��Ϊ1��1
D��NO��CO��CO2��N2�����ʵ���֮��Ϊ2��2��2��1
��3����Ҫ�ӿ췴Ӧ������Ҫ���NOת���ʣ����д�ʩ���е���____________��
��A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
��C�����ͷ�Ӧ��ϵ���¶� D����С���������
��4��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ�ij��ѧ����ij�¶��������崫������ò�ͬʱ���NO��COŨ����������������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) ( molL��1) | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
c(CO) ( molL��1) | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | X | 2.70��10��3 |
�ӱ������ݷ�����֪��
��X��____________mol��L��1��
��ǰ2s�ڵ�ƽ����Ӧ����v(N2)��________________________mol��L��1��s��1��
�۸��¶��·�Ӧ��ƽ�ⳣ��K��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������з�Ӧ�У�ˮ�Ȳ������������ֲ��ǻ�ԭ������
A��2Na+2H2O=2NaOH+H2�� B��Cl2+H2O=HCl+HClO
C��2F2+2H2O=4HF+O2 D��3Fe+4H2O![]() Fe3O4+4H2��
Fe3O4+4H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com