
【题目】锗铜合金是一种常用的标准电阻材料,工业生产中会出现一些技术指标达不到要求的合金,为避免资源浪费可利用如下流程对不达标合金中的锗、铜进行回收,请回答相关问题。
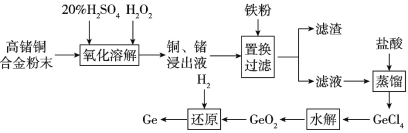
(1)锗在元素周期表中的位置是____。
(2)氧化溶解过程中铜参与反应的离子方程式是___。为加快氧化溶解反应速率可采用的措施有___(任写两种)。
(3)滤渣的成分是_____。
(4)水解过程发生的反应是GeCl4+2H2O=GeO2↓+4HCl,为得到纯净的GeO2,对水解所得混合物要进行过滤、洗涤、干燥等操作,判断GeO2是否洗涤干净的操作是__。
(5)下列金属的冶炼原理与流程中锗的冶炼原理相似的是____(填选项序号)。
A.钠 B.铝 C.铁 D.银
(6)若含锗6.2%的高锗铜合金的质量为50kg,还原过程中参与反应的H2体积为1.792m3(已折合为标准状况),则锗的回收率为____(保留三位有效数字)。
【答案】第四周期ⅣA族 Cu+H2O2+2H+=Cu2++2H2O 搅拌、适当加热、适当增大硫酸浓度 铜、铁 取少量最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,则GeO2已洗涤干净,如果有沉淀,则没有洗涤干净。 C 94.2%
【解析】
(1)锗与碳同族,根据元素周期表,该元素在第四周期ⅣA族,答案为:第四周期ⅣA族;
(2)氧化溶解过程中铜在酸性条件下与双氧水反应生成硫酸铜和水,离子方程式Cu+H2O2+2H+=Cu2++2H2O。为加快氧化溶解反应速率即加快反应速率,可采用的措施有搅拌、适当加热、适当增大硫酸浓度。答案为:Cu+H2O2+2H+=Cu2++2H2O;搅拌、适当加热、适当增大硫酸浓度;
(3)置换过滤过程是用铁置换铜,铁粉会适当过量,因此滤渣成分是铜和过量的铁。
答案为:铜、铁。
(4)根据题干反应GeCl4+2H2O=GeO2↓+4HCl,要检验GeO2是否洗干净,主要检验是否存在氯离子,检验方法为:取少量最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,则GeO2已洗涤干净,如果有沉淀,则没有洗涤干净。
答案为:取少量最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,则GeO2已洗涤干净,如果有沉淀,则没有洗涤干净。
(5)锗的冶炼方法是热还原法,钠、铝的冶炼方法是电解法,铁的冶炼方法是热还原法,银的冶炼方法是热分解法,因此答案选C。
(6)根据质量分数,原合金中锗的质量为3.1kg,还原过程发生反应的方程式是GeO2+2H2![]() Ge+2H2O,根据方程式可算出制得锗的质量为2.92kg,因此锗的回收率=
Ge+2H2O,根据方程式可算出制得锗的质量为2.92kg,因此锗的回收率=![]() ,答案为:94.2%。
,答案为:94.2%。


科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系 如图所示,下列说法中不正确的是( )

A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7与FeSO4开始反应时物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。己知NaNO2和HI能发生如下反应:______NaNO2 +_______HI →_________NO↑+_____ I2 + _________NaI +_____
(1)请将生成物补充完整并配平,并用单线桥法标出电子转移的方向和数目。___________
(2)上述反应中氧化剂与还原剂的物质的量之比为_________,若标准状况下生成3.36L NO,则反应中转移电子的数目是______________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒⑤食醋,进行实验选用物质合适的是______(填字母编号)。
A.①③ ⑤ B.①② ④ C.①②⑤ D.②④⑤
(4)某工厂废液中,含有2%—5%的NaNO2,直接排放会造成污染,采用NH4Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______________。
(5)把氯气通到NaNO2溶液中,生成NaNO3和HCl,写出反应的离子方程式:______。
(6)亚硝酸盐可将正常的携氧亚铁血红蛋白转化成三价铁血红蛋白,失去携氧能力,引起组织缺氧导致中毒。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中不正确的是_______。
A.在中毒过程中携氧亚铁血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时三价铁血红蛋白被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:

⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研机构研发了一种以氢气为原料的新型化学电源,该电源的两个电极上分别会消耗和生成氢气,其原理如图所示,下列说法正确的是
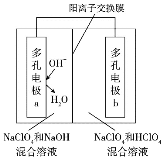
A. 电极a上发生的反应为:4OH--4e-=O2↑+2H2O
B. 电源工作时若不补充电解质两侧溶液都逐渐转化为NaClO4溶液
C. 电子从多孔电极b经导线流向多孔电极a
D. 该电源投入商用的主要难关是低成本氢气的大量获取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是研究物质所含微粒集体的多少,单位为mol
B.物质的量把微观粒子数目与宏观物质的质量联系起来
C.1molNaCl晶体中含有NA个NaCl分子
D.12gC-12中所含的原子数为阿伏加德罗常数,NA近似为6.02×1023mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄是一味常见的中草药,汉代的《神农本草经》记载有麻黄的效用:主中风,伤寒头痛,温疟,发表出汗,去邪热气,止咳逆上气,除寒热,破症坚积聚。麻黄的有效成分麻黄碱(物质F)有多种合成方法,合成方法之一如图所示,请回答相关问题。
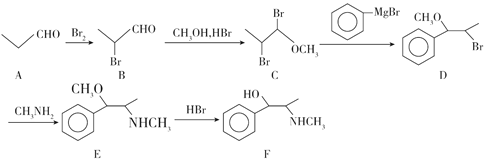
(1)C中含有的官能团名称是____。
(2)D→E的反应类型是____。
(3)A与新制Cu(OH)2悬浊液反应的化学方程式是____。
(4)下列关于麻黄碱的说法错误的是_____(填选项序号)。
a.麻黄碱与盐酸、NaOH溶液均可反应
b.麻黄碱可以发生消去、取代、加成反应
c.麻黄碱中的氮原子和所有碳原子可能共面
(5)麻黄碱的同分异构体中满足下列条件的有____种,其中核磁共振氢谱有6个峰且三个取代基均不处于相邻位置的结构简式是___。
①苯环上有三个取代基,其中一个是 NH2;②遇到FeCl3溶液显紫色。
(6)设计由乙醇和![]() 制备苯甲酸的合成路线____(无机试剂任选)。
制备苯甲酸的合成路线____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com