
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:

⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ NaAlO2+NH4Cl+H2O=Al(OH)3+NaCl+NH3↑ 取最后一次洗涤滤液,加入稀硝酸酸化的AgNO3溶液,若无白色沉淀产生则洗涤干净 Al3+很容易水解,生成氢氧化铝Al(OH)3胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+;氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清 盐酸 铁粉
Al(OH)3(胶体)+3H+;氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清 盐酸 铁粉
【解析】
易拉罐中的Al会与NaOH反应生成NaAlO2,而Fe不反应,过滤除去;加入NH4Cl,与AlO2-发生双水解,得到Al(OH)3,最终得到明矾。
(1)易拉罐(主要成分是Al、Fe),遇到氢氧化钠,铝反应,铁不反应,故“反应Ⅰ”时的离子反应方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)过滤得到的滤液含有偏铝酸钠,加入氯化铵,氨气,偏铝酸根离子与铵根离子发生双水解,故方程式是NaAlO2+NH4Cl+H2O=Al(OH)3↓+NaCl+NH3↑ ;
(3)氢氧化铝表面可能有氯离子,所以检验Al(OH)3已洗涤干净的方法是取最后一次洗涤滤液,加入硝酸酸化的AgNO3溶液,若无白色沉淀产生则洗涤干净;
(4)明矾溶于水会电离出铝离子,铝离子水解生成氢氧化铝胶体,可以吸附水中的悬浮物,故答案是Al3+很容易水解,生成氢氧化铝Al(OH)3胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+;氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清;
Al(OH)3(胶体)+3H+;氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清;
(5)Fe和水蒸气在高温下反应后所得固体产物X是四氧化三铁,先加盐酸使其溶解,生成氯化铁,氯化亚铁,再加入铁,生成氯化亚铁,故加入的先后顺序是盐酸,铁粉。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】化合物G是一种具有抗疟药理活性的喹啉类衍生物,其合成路线流程图如下:

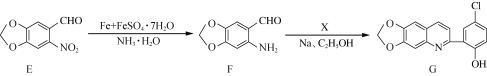
已知:
(1) F中的含氧官能团名称为________、________。
(2) B→C的反应类型为________。
(3)芳香族化合物X的分子式为C8H7ClO2,写出X的结构简式:___________________________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________________________。
①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)写出以 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3BrF3 + 5H2O = Br2 + HBrO3 + O2↑ + 9HF,当生成3 mol Br2时,被水还原的BrF3的物质的量为
A.9 molB.6 molC.4 molD.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
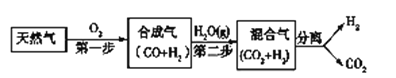
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
用H2 表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= ________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
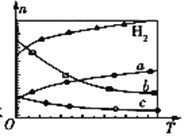
①该反应的ΔH ______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为 ____________________。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
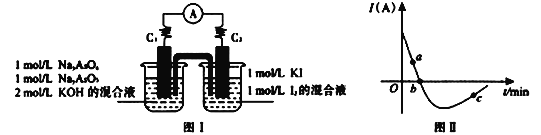
(1)图II中AsO43-的逆反应速率:a____b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________。
(3)能判断该反应达到平衡状态的是________。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共0.1 mol,完全燃烧得0.16 mol二氧化碳和3.6 g水。下列说法正确的是( )
A. 一定有甲烷 B. 一定是甲烷和乙烯 C. 可能有乙烷 D. 一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.FeCl3溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
B.Al2O3溶于烧碱溶液:2Al3++3O2-+2OH-=2AlO![]() +H2O
+H2O
C.Al(OH)3溶于稀硫酸:Al(OH)3+3H+=Al3++3H2O
D.氢氧化钡溶液与硫酸溶液反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗铜合金是一种常用的标准电阻材料,工业生产中会出现一些技术指标达不到要求的合金,为避免资源浪费可利用如下流程对不达标合金中的锗、铜进行回收,请回答相关问题。
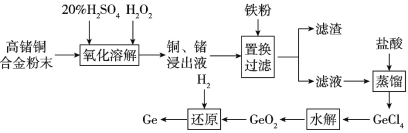
(1)锗在元素周期表中的位置是____。
(2)氧化溶解过程中铜参与反应的离子方程式是___。为加快氧化溶解反应速率可采用的措施有___(任写两种)。
(3)滤渣的成分是_____。
(4)水解过程发生的反应是GeCl4+2H2O=GeO2↓+4HCl,为得到纯净的GeO2,对水解所得混合物要进行过滤、洗涤、干燥等操作,判断GeO2是否洗涤干净的操作是__。
(5)下列金属的冶炼原理与流程中锗的冶炼原理相似的是____(填选项序号)。
A.钠 B.铝 C.铁 D.银
(6)若含锗6.2%的高锗铜合金的质量为50kg,还原过程中参与反应的H2体积为1.792m3(已折合为标准状况),则锗的回收率为____(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案:

下列分析正确的是
A.若m1>m2时,则混合物M中一定含有Al2O3
B.生成蓝色溶液的离子方程式为:Cu+Fe3+=Cu2++Fe2+
C.固体B既可能使纯净物,又可能是混合物
D.要确定混合物M中是否含有Al,可取M加入适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列填空:
(1)当SO2和SO3中分子个数比为1:1 时,原子总数之比为____,质量之比为____。
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是______。
(3)中和含0.2molHCl的稀盐酸,需NaOH的物质的量为_______;如改用KOH,则所需KOH的质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com