
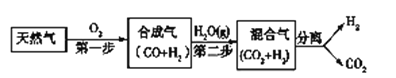
【题目】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
用H2 表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= ________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
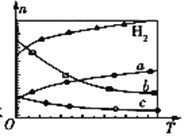
①该反应的ΔH ______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为 ____________________。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
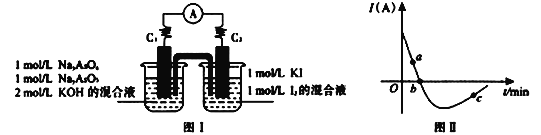
(1)图II中AsO43-的逆反应速率:a____b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________。
(3)能判断该反应达到平衡状态的是________。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
【答案】0.225 ![]() MPa-2(或0.021MPa-2) < C2H4 < AsO43-+2e-+2H+=AsO33-+H2O bcd
MPa-2(或0.021MPa-2) < C2H4 < AsO43-+2e-+2H+=AsO33-+H2O bcd
【解析】
I. (1)列出三段式,找出浓度变化量,再根据v(H2)=![]() 计算;
计算;
(2) 列出三段式,找出CO2、H2、CH3OH、H2O的分压,再根据v(H2)=Kp=![]() 计算;
计算;
(3)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,ΔH<0。
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,由计量数关系可知曲线b代表水,曲线c代表C2H4。
II. (1)随着反应的进行,离子浓度减小,电流减小,正反应速率减小,逆反应速率增大,故图II中AsO43-的逆反应速率:a<b;
(2)图II中c点酸性条件下对应图I装置的正极AsO43-得电子产生AsO33-;
(3)a.根据速率关系,v(I-)正=2v(AsO33-)逆 ,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;
c.电流表示数变为零则氧化还原反应中电子转移不再增减,反应物的浓度保持不变,反应处于平衡状态;
d.溶液颜色不再变化,则碘单质的浓度保持不变,反应处于平衡状态;
I. (1)由反应前后的压强关系可知2 h时,体系中气体的总的物质的量为4mol![]() 0.85=3.4 mol,减少了0.6 mol。
0.85=3.4 mol,减少了0.6 mol。
CO2(g) + 3H2(g)![]() CH3OH(g)+ H2O(g) Δn(减少)
CH3OH(g)+ H2O(g) Δn(减少)
起始(mol) 1 3 0 0 2
变化(mol) 0.3 0.9 0.3 0.3 0.6
2h末(mol) 0.7 2.1 0.3 0.3
v(H2)=![]() =
=![]() =0.225 mol·L-1·h-1。
=0.225 mol·L-1·h-1。
因此,本题正确答案是:0.225;
(2)设开始时投入CO2和H2的物质的量分别为1 mol和3 mol。
CO2(g) + 3H2(g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
起始(mol) 1 3 0 0
变化(mol) 0.5 1.5 0.5 0.5
平衡(mol) 0.5 1.5 0.5 0.5
则平衡时
p(CO2)=8 MPa×![]() =4/3 MPa, p(H2)=8 MPa×
=4/3 MPa, p(H2)=8 MPa×![]() =4 MPa,p(CH3OH)=8 MPa×
=4 MPa,p(CH3OH)=8 MPa×![]() =4/3 MPa,p(H2O)=8 MPa×
=4/3 MPa,p(H2O)=8 MPa×![]() =4/3 MPa,Kp=
=4/3 MPa,Kp=![]() =
=![]() =
=![]() ≈0.021(MPa-2)。
≈0.021(MPa-2)。
因此,本题正确答案是:![]() MPa-2(或0.021MPa-2);
MPa-2(或0.021MPa-2);
(3)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,ΔH<0。
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,由计量数关系可知曲线b代表水,曲线c代表C2H4。
因此,本题正确答案是:<;C2H4;
II. (1)随着反应的进行,离子浓度减小,电流减小,正反应速率减小,逆反应速率增大,故图II中AsO43-的逆反应速率:a<b;
因此,本题正确答案是:<;
(2)图II中c点酸性条件下对应图I装置的正极AsO43-得电子产生AsO33-,电极反应式为AsO43-+2e-+2H+= AsO33-+H2O;
因此,本题正确答案是:AsO43-+2e-+2H+=AsO33-+H2O;
(3)a.根据速率关系,v(I-)正=2v(AsO33-)逆 ,则等式始终成立,反应不一定处于平衡状态;b.溶液的pH不再变化,则氢氧根离子浓度也保持不变,反应处于平衡状态;
c.电流表示数变为零,则氧化还原反应的正反应速率与逆反应速率相等,反应物的浓度保持不变,反应处于平衡状态;
d.溶液颜色不再变化,则碘单质的浓度保持不变,反应处于平衡状态;
因此,本题正确答案是:bcd。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的 CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐![]() 滤液
滤液![]() 滤液
滤液 精盐,下列说法不正确的是
精盐,下列说法不正确的是
A.第②步过滤出的滤渣是泥沙
B.在第④步中不能用 KOH 替代 NaOH
C.第⑤步加入 Na2CO3 溶液的目的是除去 Ba2+
D.第③、④、⑤步添加试剂的操作顺序还可以是:NaOH、BaCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器相同条件下充入等物质的量的![]() 气体,且起始时体积相同,发生反应:2NO2(g)
气体,且起始时体积相同,发生反应:2NO2(g)![]() N2O4(g) H <0 一段时间后相继达到平衡状态下列说法中正确的是( )
N2O4(g) H <0 一段时间后相继达到平衡状态下列说法中正确的是( )
A. 平衡时![]() 体积分数:甲<乙
体积分数:甲<乙
B. 达到平衡所需时间,甲与乙相等
C. 该反应的平衡常数表达式K=![]()
D. 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A、 |
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。己知NaNO2和HI能发生如下反应:______NaNO2 +_______HI →_________NO↑+_____ I2 + _________NaI +_____
(1)请将生成物补充完整并配平,并用单线桥法标出电子转移的方向和数目。___________
(2)上述反应中氧化剂与还原剂的物质的量之比为_________,若标准状况下生成3.36L NO,则反应中转移电子的数目是______________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒⑤食醋,进行实验选用物质合适的是______(填字母编号)。
A.①③ ⑤ B.①② ④ C.①②⑤ D.②④⑤
(4)某工厂废液中,含有2%—5%的NaNO2,直接排放会造成污染,采用NH4Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_______________。
(5)把氯气通到NaNO2溶液中,生成NaNO3和HCl,写出反应的离子方程式:______。
(6)亚硝酸盐可将正常的携氧亚铁血红蛋白转化成三价铁血红蛋白,失去携氧能力,引起组织缺氧导致中毒。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法中不正确的是_______。
A.在中毒过程中携氧亚铁血红蛋白被氧化 B.中毒时亚硝酸盐发生氧化反应
C.药品美蓝应具有还原性 D.解毒时三价铁血红蛋白被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:
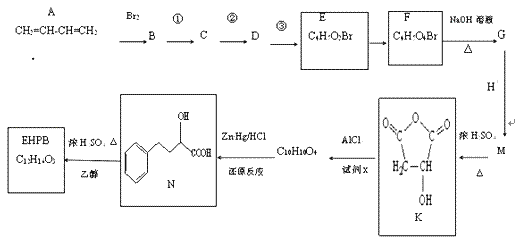
已知:ⅰ、碳碳双键容易被氧化
ii、 +CH3COOH
+CH3COOH
(1)A的名称是_____,A形成的顺丁橡胶的结构式是_____.
(2)已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为_____.
(3)E由B经①、②、③合成.
a.①的反应试剂和条件是_____.
b.②、③的反应类型依次是_____、_____.
(4)1molF转化成G所消耗的NaOH的物质的量为_____mol.
(5)M的结构简式为_____.
(6)完成下列化学方程式:
①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为_____.
②有机物K与试剂x发生反应的化学方程式为_____.
(7)有机物N有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式_____.
a.含有酚羟基 b.能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用易拉罐(主要成分是Al、Fe)制备明矾的过程如下图所示:

⑴ 写出“反应Ⅰ”时的离子反应方程式:________。
⑵ 写出“反应Ⅱ”时的化学反应方程式:________。
⑶ 过滤所得Al(OH)3需进行洗涤,检验Al(OH)3已洗涤干净的方法是:________。
⑷ 明矾能够净水的原因是________。
⑸ Fe和水蒸气在高温下反应后所得固体产物X可用于制取FeCl2溶液。请从下列试剂中选择合适的将X转化为FeCl2溶液。试剂:盐酸、NaCl溶液、Cu粉、Fe粉。依次选用的试剂为:________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是研究物质所含微粒集体的多少,单位为mol
B.物质的量把微观粒子数目与宏观物质的质量联系起来
C.1molNaCl晶体中含有NA个NaCl分子
D.12gC-12中所含的原子数为阿伏加德罗常数,NA近似为6.02×1023mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时有甲、乙、丙三种溶液,甲为0.1mol·L-1NaOH溶液,乙为0.1mol·L-1HCl溶液,丙为0.1 mol·L-1CH3COOH溶液,请回答下列问题:
(1)甲溶液的pH=___________________。
(2)乙溶液中由水电离出的c(H+)=___________________mol·L-1。
(3)写出丙的电离方程式_________________________________________________________,其电离平衡常数表达式Ka=___________________。
(4)向丙中加入乙,会_____________(“抑制”或“促进”)丙的电离,c(H+)_____________(填“增大”、“减小”或“不变”), 丙的电离平衡常数Ka_____________(填“增大”、“减小”或“不变”)。
(5)各取25 mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙) ____________V (丙)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com