
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:
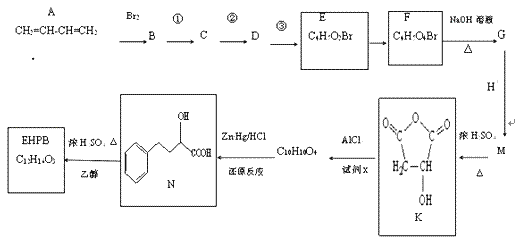
已知:ⅰ、碳碳双键容易被氧化
ii、 +CH3COOH
+CH3COOH
(1)A的名称是_____,A形成的顺丁橡胶的结构式是_____.
(2)已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为_____.
(3)E由B经①、②、③合成.
a.①的反应试剂和条件是_____.
b.②、③的反应类型依次是_____、_____.
(4)1molF转化成G所消耗的NaOH的物质的量为_____mol.
(5)M的结构简式为_____.
(6)完成下列化学方程式:
①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为_____.
②有机物K与试剂x发生反应的化学方程式为_____.
(7)有机物N有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式_____.
a.含有酚羟基 b.能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.
【答案】3-丁二烯 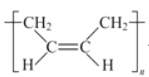 醛基 NaOH溶液、加热 加成反应 氧化反应 3
醛基 NaOH溶液、加热 加成反应 氧化反应 3 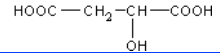
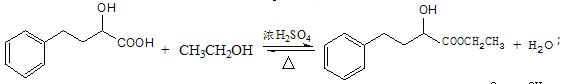
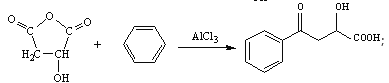
【解析】
根据题中各物质的转化关系,由K的结构简式可知,M为HOOCCH2CHOHCOOH,G为NaOOCCH2CHOHCOONa,根据F的分子式可知,F为HOOCCH2CHBrCOOH。根据C的结构简式可知B的结构简式为BrCH2CH=CHCH2Br,B发生碱性水解得C,C与溴化氢加成得D为CH2OHCH2CHBrCH2OH,D发生氧化反应得E。根据已知信息ⅱ可知K与x发生该反应,依据生成物的分子式可知x应该是苯,据此分析。
(1)CH2=CH-CH=CH2的名称是1,3-丁二烯;CH2=CH-CH=CH2加聚形成的顺丁橡胶的结构式是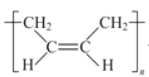 ;
;
(2)利用逆推法,由K推知M为HOOCCH2CHOH-COOH;G为NaOOCCH2CHOH-COONa;F为HOOCCH2CHBrCOOH;E为OHCCH2CHBrCHO;D为CH2OHCH2CHBrCH2OH;C为HOCH2CH=CHCH2OH;B为BrCH2CH=CHCH2Br;
(2)E中含氧官能团的名称为醛基;
(3)①BrCH2CH=CHCH2Br到HOCH2CH=CHCH2OH的反应试剂和条件是NaOH/H2O,△;②、③的反应类型依次是加成反应 、氧化反应;
(4)1molHOOCCH2CHBrCOOH转化成NaOOCCH2CHOH-COONa所消耗的NaOH的物质的量为3mol;
(5)M的结构简式为HOOCCH2CHOH-COOH;
(6)①EHPB不能与NaHCO3反应,说明EHPB不含羧基,有机物N →EHPB的化学方程式为: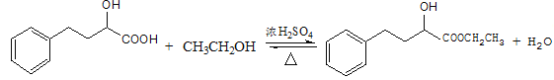 ;
;
②有机物K与试剂x发生反应的化学方程式为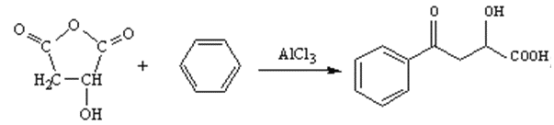 ;
;
(7)有机物N有多种同分异构体,满足下列条件的同分异构体
a. 含有酚羟基;
b.既能水解又能发生银镜反应,说明为甲酸酯
c. 苯环上的一氯代物只有一种;
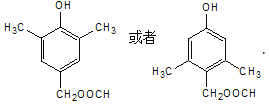
d.核磁共振氢谱有5组峰的结构简式为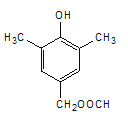 或
或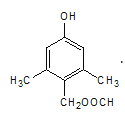 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
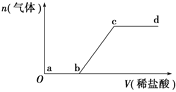
A. a点对应的溶液中:Na+、OH-、SO![]() 、NO
、NO![]()
B. b点对应的溶液中:Al3+、Fe3+、MnO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO![]() 、Cl-
、Cl-
D. d点对应的溶液中:F-、NO![]() 、Fe3+、Ag+
、Fe3+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A 元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填选项字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
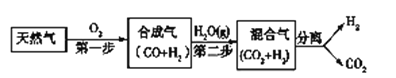
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
用H2 表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= ________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
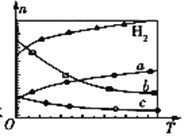
①该反应的ΔH ______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为 ____________________。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
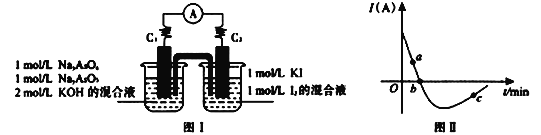
(1)图II中AsO43-的逆反应速率:a____b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________。
(3)能判断该反应达到平衡状态的是________。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要放出能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.FeCl3溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
B.Al2O3溶于烧碱溶液:2Al3++3O2-+2OH-=2AlO![]() +H2O
+H2O
C.Al(OH)3溶于稀硫酸:Al(OH)3+3H+=Al3++3H2O
D.氢氧化钡溶液与硫酸溶液反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _________℃。
Ⅱ、向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) ![]() 3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
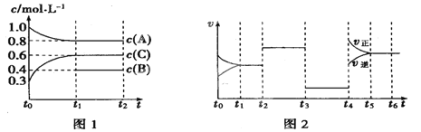
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率V(C)=_____。
(2)t3时改变的条件为___________,B的起始物质的量为_______。
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是 ( )
A.3Fe + 4H2O(g) ![]() Fe3O4 + 4H2
Fe3O4 + 4H2
B.3NO2 +H2O = 2HNO3+ NO
C.Ca(OH)2+SO2 = CaSO3 + H2 O
D.Cu+2H2SO4 (浓)![]() CuSO4+SO2↑+ 2H2O
CuSO4+SO2↑+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com