
【题目】已知热化学方程式:
①CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )

A. H2的燃烧热为241.8kJ·mol-1
B. 由反应①、②可知上图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)ΔH=-41.2 kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要放出能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1
【答案】B
【解析】
A.氢气的燃烧热是1mol氢气完全燃烧生成稳定氧化物液态水时放出热量,所以H2的燃烧热要高于241.8kJmol-1,故A错误;
B.化学反应的焓变等于产物和反应物之间的能量差,根据图示知道,该反应是放热的,根据盖斯定律,①-②得:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-283.0kJmol-1+241.8kJmol-1 = -41.2kJmol-1,故B正确;
C.H2(g)转变成H2O(g)的化学反应不一定是氢气和氧气在点燃的情况下生成,也可能是氢气和氧化铜在高温下反应生成,该反应会吸收能量,故C错误;
D.由于气态水变为液态水是一个放热过程,根据②推知反应H2(g)+![]() O2(g)=H2O(l) △H<-241.8kJmol-1,故D错误;
O2(g)=H2O(l) △H<-241.8kJmol-1,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
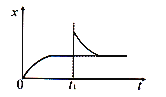
A. υ逆(逆反应速率)B. ρ(容器内气体密度)
C. m(容器内CaO质量)D. p(容器压强)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (![]() )mol B. (a+3b)mol
)mol B. (a+3b)mol
C. (![]() )mol D. (a+3b+2c)mol
)mol D. (a+3b+2c)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EHPB是合成治疗高血压和充血性心力衰竭的药物的中间体,合成路线如下:
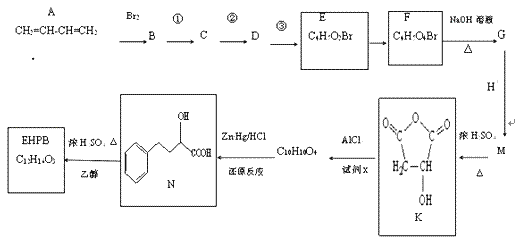
已知:ⅰ、碳碳双键容易被氧化
ii、 +CH3COOH
+CH3COOH
(1)A的名称是_____,A形成的顺丁橡胶的结构式是_____.
(2)已知1molE发生银镜反应可生成4molAg.E中含氧官能团的名称为_____.
(3)E由B经①、②、③合成.
a.①的反应试剂和条件是_____.
b.②、③的反应类型依次是_____、_____.
(4)1molF转化成G所消耗的NaOH的物质的量为_____mol.
(5)M的结构简式为_____.
(6)完成下列化学方程式:
①EHPB不能与NaHCO3反应,有机物N→EHPB的化学方程式为_____.
②有机物K与试剂x发生反应的化学方程式为_____.
(7)有机物N有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式_____.
a.含有酚羟基 b.能水解又能发生银镜反应
c.苯环上的一氯代物只有一种 d.核磁共振氢谱有5组峰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用分液漏斗向锥形瓶中滴加液体至过量,下列对锥形瓶中现象的预测符合实际情况的是
选项 | 锥形瓶 | 分液漏斗 | 预测现象 |
A | 酸性KMnO4溶液 | H2O2溶液 | 溶液紫红色逐渐褪去且产生大量气泡 |
B | Na2S溶液 | 久置氯水 | 生成淡黄色沉淀 |
C | Fe(OH)3胶体 | 盐酸 | 产生红褐色沉淀 |
D | Na2CO3溶液 | H2BO3溶液 | 产生大量气泡 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轻质碳酸镁[主要含MgCO3和Mg(OH)2]是制取氧化镁的工业原料。某研究性学习小组用如图所示装置确定轻质碳酸镁的组成。向广口瓶B中加入足量1.00 mol·L-1稀硫酸,充分反应后测得D装置增重0.88 g;向B所得溶液中加入足量NaOH溶液,过滤,将所得沉淀洗涤、低温干燥、称量所得Mg(OH)2固体为1.45 g。
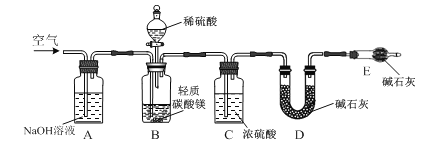
⑴ 反应后需向装置A中缓缓鼓入空气,目的是________。
⑵ 某同学旋转分液漏斗下面的活塞,发现液体不能顺利流下,可能的原因是________。
⑶ 由浓硫酸配制100mL 1.00 mol·L-1的硫酸,下列操作会使所配溶液浓度偏低的是________填字母)。
A.容量瓶使用前未干燥,有少量水残留
B.定容时,俯视容量瓶刻度线
C.加水时超过刻度线,用胶头滴管吸出多余的液体
D.稀释浓硫酸时未冷却至室温就将溶液转移入容量瓶
⑷ 该轻质碳酸镁中MgCO3和Mg(OH)2物质的量的比值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:
已知以下信息: i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
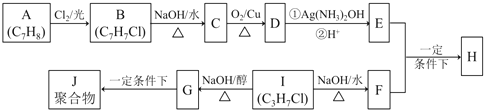
回答下列问题:
(1)E的官能团名称______________,B的结构简式_____________。
(2)B → C和G → J两步的反应类型 _______________,________________。
(3)① E + F → H的化学方程式_____________________。
② I → G 的化学方程式______________________。
(4)I的同系物K比I相对分子质量大28,K有多种同分异构体。
①K的同分异构体共_________________种。
②若K不能发生消去反应,则K的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作为还原剂的是( )
A.2F2 + 2H2O = 4HF + O2B.Na2O + H2O = NaOH
C.Br2 + H2O ![]() HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com