
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
【答案】搅拌 12NaOH+2Ti3O5+O2![]() 6Na2TiO3+6H2O Na2SiO3 用水量过大,导致滤液浓度过低,蒸发浓缩时能耗增加(或蒸发浓缩时间过长) TiOSO4+2H2O
6Na2TiO3+6H2O Na2SiO3 用水量过大,导致滤液浓度过低,蒸发浓缩时能耗增加(或蒸发浓缩时间过长) TiOSO4+2H2O![]() H2TiO3↓+H2SO4 将溶液中的Fe3+还原为Fe2+,以便除去杂质铁,提高H2TiO3的纯度
H2TiO3↓+H2SO4 将溶液中的Fe3+还原为Fe2+,以便除去杂质铁,提高H2TiO3的纯度
【解析】
(1)①搅拌可使反应物混合均匀;
②Ti3O5转化为Na2TiO3,钛元素化合价升高,根据氧化还原反应的规律书写并配平化学方程式;
(2)①加入氢氧化钠后,二氧化硅会与氢氧化钠反应生成水溶性的硅酸钠;
②考虑后续的蒸发结晶耗能问题分析作答;
(3)根据水解原理结合产物书写化学方程式;
(4)根据提示给定信息,“H2TiO3中的杂质Fe2+比Fe3+更易水洗除去”来分析作答。
(1)①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可适当搅拌,因为搅拌可使反应物混合均匀,增加反应物的接触机会,从而达到加快反应速率的目的,
故答案为:搅拌;
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,发生氧化还原反应,其化学方程式为:12NaOH+2Ti3O5+O2![]() 6Na2TiO3+6H2O,
6Na2TiO3+6H2O,
故答案为:12NaOH+2Ti3O5+O2![]() 6Na2TiO3+6H2O;
6Na2TiO3+6H2O;
(2) ①熔盐时加入的氢氧化钠会与少量杂质SiO2反应,其化学方程式为:2NaOH+SiO2 = Na2SiO3+H2O,生成的硅酸钠易溶于水,则“滤液”中含有少量Na2SiO3,
故答案为:Na2SiO3;
②“水浸”时,用水量过大,导致滤液浓度过低,蒸发浓缩时能耗增加(或蒸发浓缩时间过长),
故答案为:用水量过大,导致滤液浓度过低,蒸发浓缩时能耗增加(或蒸发浓缩时间过长);
(3)“酸溶”后获得的TiOSO4会发生水解,经加热煮沸生成难溶于水的H2TiO3,其化学方程式为:TiOSO4+2H2O![]() H2TiO3↓+H2SO4,
H2TiO3↓+H2SO4,
故答案为:TiOSO4+2H2O![]() H2TiO3↓+H2SO4;
H2TiO3↓+H2SO4;
(4)根据给定信息易知,“脱色”步骤中加入还原性的Ti2(SO4)3,是为了将溶液中的Fe3+还原为Fe2+,以便除去杂质铁,提高H2TiO3的纯度,且不引入新的杂质,
故答案为:将溶液中的Fe3+还原为Fe2+,以便除去杂质铁,提高H2TiO3的纯度。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】写出木炭与浓硫酸反应的化学方程式____。
为了验证产物中的二氧化碳气体,甲、乙两同学分别设计如下实验(已知Br2+2H2O+SO2=H2SO4+2HBr):
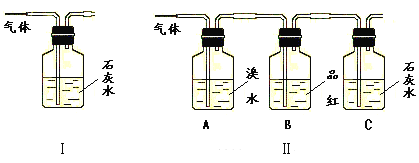
请回答下列问题:
(1)能否根据Ⅰ装置中石灰水变浑浊的现象说明产物中一定有二氧化碳气体?___,理由是____。
(2)Ⅱ装置中A的作用是___;B的作用是___。
(3)根据B中品红__,C中产生___,说明产物中一定有二氧化碳气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是两种有机物的球棍模型:![]() 代表H原子,
代表H原子,![]() 代表C原子,请回答下列问题:
代表C原子,请回答下列问题:
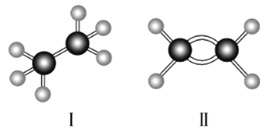
(1)Ⅰ的分子式为________,Ⅱ的结构简式为________。
(2)由Ⅱ变成Ⅰ的化学反应类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2NO2(红棕色)![]() N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到了平衡状态
B. b点对应的时刻改变的条件是将注射器的活塞向外拉
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应X(g)+3Y(g)2Z(g)达化学平衡状态的标志是
A. Z的生成速率与Z的分解速率相等
B. 单位时间生成amolX,同时生成3a molY
C. X、Y、Z的浓度相等
D. X、Y、Z的分子数比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,将15L O2通往10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中,V(CO)=__________L,V(H2)=___________L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中,V(CO): V(H2)=_______。
(3)若剩余气体的体积为a L,则a的取值范围是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com