
【题目】下列分子的空间结构呈正四面体形的是
A.甲烷B.乙烯C.乙炔D.乙烷
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于![]() (螺[2,2]戊烷)的说法正确的是
(螺[2,2]戊烷)的说法正确的是
A. 一氯代物的结构只有一种
B. 与戊烯互为同分异构体
C. 所有碳原子均处同一平面
D. 能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 把100mL3mo/LH2SO4溶液与100mL1mo/LBaCl2溶液混合,所得溶液c(SO42-)变为1mol/L
B. 把200mL3mol/LBaCl2溶液与100mL3mol/LKCl 溶液混合后,所得溶液c(Cl-)仍为3mol/L
C. 把100mL20%的NaOH溶液与100mLH2O混合后,所得溶液中NaOH的质量分数为10%
D. 把100g20%的NaCl溶液与100mLH2O混合后,所得溶液中NaCl的质量分数为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是可被细菌作为碳源和能源利用的聚合物,属于一种生物可降解高分子材料,在食品、药品包装方面具有独特优势。已知A~G均为有机化合物,以下为高分子化合物G的一种合成路线:
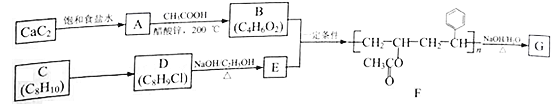
回答以下问题:
(1)由CaC2制备A的化学方程式为_________________________________。
(2)A生成B的反应类型为______________________。
(3)C的化学名称是___________,C→D所需试剂和条件分别是___________、___________。
(4)E的结构简式为______________________。
(5)芳香族化合物H是D的同分异构体,则H可能的结构共有___________种(不包括D),写出核磁共振氢谱有三组峰且峰面积之比为1︰2︰6的H的同分异构体的结构简式___________(任写一种)。
(6)由F生成G的化学方程式为_________________________________。
(7)参考题中信息,设计由1,2二氯乙烷和冰醋酸为原料制取![]() 的合成线路图(无机试剂任选)__________________。
的合成线路图(无机试剂任选)__________________。
已知:-OH与碳碳双键两端的碳原子直接相连不稳定,会自变成—CHO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响

(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________。

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: ____________________________(实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq) ![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在25 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如下图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
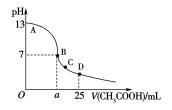
A. 在A、B间任一点,溶液中一定都c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. 在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 在D点:c(CH3COO-)+c(CH3COOH)=0.1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com