
����Ŀ���Ը���ұ���̻�(��Ҫ�ɷ�Ϊͭп���Ȼ������������Σ�������Ԫ�غ���Ԫ��)Ϊԭ�ϣ��ɻ����Ʊ�Cu��ZnSO4��H2O������Ҫʵ���������£�

��֪����Fe3����ȫ����pHΪ3.2����ʱZn2����Cu2��δ��ʼ��������K3[Fe(CN)6]�����ڼ���Fe2����3Fe2����2[Fe(CN)6]3��===Fe3[Fe(CN)6]2��(����ɫ)������Ԫ�ؽ���ˮ���жԻ�����Ⱦ��ͨ����������ȥ��
(1)�������Ⱦ�����85 �������½��У����˵ļ��ȷ�ʽΪ________��
(2)��ϴ����ʱ����Һ��Cu2����Ҫת��ΪCu(OH)2��Cu2(OH)2CO3��Ҳ�ᷢ������Ӧ�õ�Cu2(OH)3Cl�������ų����壬�ø���Ӧ�����ӷ���ʽΪ________________________������NaOH��Һ���м�ϴ����ʱ��Ũ�Ȳ��˹���ͨ���±������ݷ�����ԭ����___________��
NaOH��ҺŨ�ȶ������ʺ�����Ԫ�ؽ����ʵ�Ӱ��

(3)ZnSO4���ܽ����������ͼ��ʾ������⡱����Һ�л���ZnSO4��H2O��ʵ�顢����Ϊ___________��

(4)��Һ1����Һ2�к�һ������Cu2����Zn2����Ϊ���ԭ�������ʣ��ɲ�ȡ�Ĵ�ʩ�У�����Һ1����Һ2��ϣ�����ͭп�����ѭ��ʹ�õ����̲�����________(�ѧʽ)��
(5)��֪H3AsO3�Ļ�ԭ��ǿ��Fe2����Ksp(FeAsO3)>Ksp(FeAsO4)��5.7��10��21��������Һ��������Ԫ��(��Fe2������)����Ԫ��(��H3AsO3����)��Ũ�ȷֱ�Ϊ1.15 g��L��1��0.58 g��L��1���ɲ��á������к�����������ȥ�������ʵ�鷽���� ____________________________(ʵ������ʹ�õ��Լ��У�30%˫��ˮ��0.001 mol��L��1K3[Fe(CN)6]��Һ�����յ�ͭп������)��
���𰸡�ˮԡ����(��85��ˮԡ����) 4Cu2����3CO32-��2Cl����3H2O===2Cu2(OH)3Cl����3CO2�� NaOH��ҺŨ�ȸ�ʱZnԪ����ʧ�϶ࣻAsԪ�ؽ����ʸߣ����ӷ�ˮ�����Ѷ� ��330 K����(330��380 K��Χ�ڽԿ���)�����ᾧ�����ȹ��ˣ���ˮϴ�Ӹ��� H2SO4 �������Һ�м������30%˫��ˮ������ʹ���ַ�Ӧ��ȡ���μ�0.001 mol��L��1K3[Fe(CN)6]��Һ��������ɫ������������յ�ͭп�����������������pHΪ3.2�����ã����ˣ�ȡ��Һ
��������
��1��ֱ�Ӽ����¶Ȳ��ɿأ���ˮԡ���ȿ����¶�ƽ�ȵؿ��Ƶ������¶�������
��2����Ӧǰ�����ϼ۵���������ų�������ӦΪ������̼���壬�ݴ���д��ѧ����ʽ���Աȱ����ó���������Ũ�ȸ�ʱ��пԪ������Ԫ�ؽ�������������ʵ�ʹ�ҵ��������
��3������ZnSO4���ܽ���������þ���ɷַ������Ƶ��¶ȷ�Χ���ٽ������Ũ������ȴ�ᾧ��ʵ��������
��4������Ժ�������ͭ�Ʊ�ͭ���ʣ����ݵ��ԭ�������������Ϲ������̵ó����ۣ�
��5��H3AsO3�Ļ�ԭ��ǿ��Fe2�����ɲ��ù�������������������Һ��û��Fe2�������������ף���H3AsO3������ΪH3AsO4����Fe2��������ΪFe3������ϸ�������֪��Ϣ������pH������ȥ����
��1��ˮԡ���ȿɱ���ֱ�Ӽ��ȴ������¶Ȳ��ȶ������أ���Ϊ��ʹ�¶ȿ�����85�棬�����˵ļ��ȷ�ʽΪ��ˮԡ����(��85��ˮԡ����)��
�ʴ�Ϊ��ˮԡ����(��85��ˮԡ����)��
��2��Cu2����̼������Һ�У�ת��ΪCu2(OH)3Cl�������ų�������̼����ķ�Ӧ����ʽ�ɱ�ʾΪ��4Cu2����3CO32-��2Cl����3H2O===2Cu2(OH)3Cl����3CO2��������NaOH��Һ���м�ϴ����ʱ��Ũ�Ȳ��˹������ݱ������ݷ��֣���������Ũ�ȴ�1.0mol/L��3.0mol/L, ������õ���ZnSO4��H2O��пԪ����ʧ������������Ԫ�ؽ����ʴ�0��78.22%������֪��Ϣ��֪����Ԫ�ع��࣬��Ԫ�ؽ���ˮ���жԻ�����Ⱦ����˻������ˮ�����Ѷȣ�
�ʴ�Ϊ��4Cu2����3CO32-��2Cl����3H2O===2Cu2(OH)3Cl����3CO2����NaOH��ҺŨ�ȸ�ʱZnԪ����ʧ�϶ࣻAsԪ�ؽ����ʸߣ����ӷ�ˮ�����Ѷȣ�
��3�����ܽ�������п��Կ������¶���330 K�Ժ����õľ���ɷ�Ϊʵ�������ZnSO4��H2O�����ܽ�������¶ȵ����߶����ͣ�Ϊ�õ��þ��壬�ɽ��еIJ����ǣ���330 K����(330��380 K��Χ�ڽԿ���)�����ᾧ�����ȹ��ˣ���ˮϴ�Ӹ��
�ʴ�Ϊ����330 K����(330��380 K��Χ�ڽԿ���)�����ᾧ�����ȹ��ˣ���ˮϴ�Ӹ��
(4)�������ͭ�Ʊ�ͭ���ʵĹ��̣�����������������������Һ�е����������ӷŵ�������������ᣬ����ϡ������ظ������ٴ��������������ʱʹ�ã�
�ʴ�Ϊ��H2SO4��
(5)������֪��Ϣ֪��Ҫ���ȥ���Һ��������Ԫ��(��Fe2������)����Ԫ��(��H3AsO3����)�ɿ������ù�����������Fe2����H3AsO3����H3AsO3�Ļ�ԭ��ǿ��Fe2����������֪��Ϣ��֪��0.001 mol��L��1K3[Fe(CN)6]��Һ��Ϊ����Fe2�����Լ�������Fe2����֤��������Ԫ�ء���Ԫ���ѳ���������Ԫ��(��Fe2������)����Ԫ��(��H3AsO3����)��Ũ�ȷֱ�Ϊ1.15 g��L��1��0.58 g��L��1��ת��Ϊ���ʵ���Ũ�ȷֱ�ԼΪ0.018 mol/L��0.008 mol/L�����ɵ�Fe3����AsO43-��һ��һ��Ӧ����FeAsO4������Fe3����ʣ�࣬�������֪��Ϣ֪Fe3����ȫ����pHΪ3.2����ʱZn2����Cu2��δ��ʼ��������˿ɵ�����ҺpH= 3.2ȥ��ʣ���Fe3�������ù��ˣ����ȡ��Һ���ɣ�
�ʴ�Ϊ���������Һ�м������30%˫��ˮ������ʹ���ַ�Ӧ��ȡ���μ�0.001 mol��L��1K3[Fe(CN)6]��Һ��������ɫ������������յ�ͭп�����������������pHΪ3.2�����ã����ˣ�ȡ��Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��21�������ѵ����磬���ײ��϶������ѣ�TiO2�����кܸߵĻ�ѧ���ԣ��������������Ĵ�������ҵ�϶������ѵ��Ʊ��ǣ�

I���������Ľ��ʯ����Ҫ�ɷ�TiO2����Ҫ����SiO2����̼�ۻ��װ���Ȼ�¯�У��ڸ�����ͨ��Cl2��Ӧ�Ƶû���SiCl4���ʵ�TiCl4��
II����SiCl4���룬�õ�������TiCl4������ȡ�IJ���������_______
III����TiCl4�Ʊ�TiO2��xH2O�Ļ�ѧ����ʽΪ________________���Ʊ�ʱ��Ҫ________���ٽ�ˮ��������ȫ��
IV��TiO2��xH2O���·ֽ�õ�TiO2������ʵ�����н��У�������________�����������ƣ��м��ȡ�
��2����������(SOCl2)��һ��Һ̬������е�Ϊ77�棬��ũҩ��ҩ��������;�㷺��SOCl2��ˮ���ҷ�Ӧ��Һ�����а����γɣ����д��̼�����ζ�������ݳ����������ʹƷ����Һ��ɫ����������ʵ�飬д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ_________________________________________________��AlCl3��Һ�������յò�����ˮAlCl3������SOCl2��AlCl3��6H2O��Ϲ��ȣ��ɵ���ˮAlCl3����ԭ����______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ����Һ��һ������������ǣ� ��
A. ����AlO2-����Һ�У�Na+ ��Al3+��Cl-��K+
B. ��������ˮ�������c(H��)��c(OH��)��10��20 mol2��L��2����Һ�У�Na����NH![]() ��Cl��
��Cl��
C. ������ c(Fe3��)��0.1 mol��L��1����Һ�У�K����ClO����SO42����SCN��
D. ��c(H+)=1.0��10-13 mol��L-1����Һ�У�Na+��S2����AlO2����SO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��(NaBH4)��Ӧ�ù㷺�����ܽϺõĻ�ԭ���������ᡢ�״����⻯��(NaH)Ϊԭ�Ͽ��Ƶ����⻯�ơ�ijѧϰС���ͬѧ��������ͼ��ʾ·����ʵ���Һϳ����⻯�ơ�

I.�⻯�Ƶ��Ʊ�
��֪NaH�Ļ�ѧ��Ӧ���Ժܸߣ��ڳ�ʪ�Ŀ���������ȼ������Ӵ����ų�������������ȼ��������ը����С���ͬѧ������ͼ�е�װ����ʵ������ȡNaH��

(1)NaH����Ԫ�صĻ��ϼ�Ϊ___________��NaH�ĵ���ʽΪ___________��
(2)�������������Ӹ������ӿڣ�˳��Ϊa��___________b��c(��ӿ���ĸ)������װ�ú����ʵ�飬�ڸ�װ��B����ǰ��������е�һ��������___________��
(3)װ��A��ʢװϡ�������������Ϊ___________��װ��D��Ӧʢװ���Լ���___________��
(4)����������ʵ��װ����һ�����ԵIJ�����____________������˲���Ĵ�ʩ��__________��
��.���⻯�Ƶ��Ʊ��봿�Ȳⶨ
�ڽ�����ȵ�220��ʱ����ʢװNaH�����Ϸ�Ӧ���м�������������[B(OCH3)3]�����µ�260�棬��ַ�Ӧ���������õ�NaBH4�ͼ״��ơ�
(5)ijͬѧ��ͨ���ⶨ���⻯����ˮ��Ӧ����������������ⶨ���⻯�Ʋ�Ʒ�Ĵ��ȡ�
��֪��NaH+H2O=H2��+NaOH��
�����⻯����ˮ��Ӧ���Բ�������������ƫ�����ƣ��÷�Ӧ����ʽΪ___________��
�ڸ�ͬѧ��ͼװ�òⶨ���⻯�Ʋ�Ʒ�Ĵ���(����ֻ���⻯��)��װ����a��������_________����ȡ6.28g�⻯����Ʒ���ظ�ʵ��������Σ�������������ƽ�����Ϊ13.44L(������Ϊ��״��)������Ʒ�����⻯�ƵĴ���Ϊ___________%(���������λ��Ч����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��I2��ˮ���ܽ�Ⱥ�С����KI��Һ���ܽ����������I2��KI��Һ�д�������ƽ�⣺I2(aq)��I��(aq)![]() I3��(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ������ͼ��ʾ������˵����ȷ���ǣ�������
I3��(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ������ͼ��ʾ������˵����ȷ���ǣ�������

A. ��ӦI2(aq)��I-(aq)![]() I3 -(aq)�Ħ�H>0
I3 -(aq)�Ħ�H>0
B. ���ø÷�Ӧ���Գ�ȥ����������ĵⵥ��
C. ������ƽ����ϵ�м���CCl4��ƽ�ⲻ�ƶ�
D. 25��ʱ��������ƽ����ϵ�м�������KI���壬ƽ�ⳣ��KС��680
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ı�0.1mol��L��1H2SO3��Һ��pH�����������ʵ��������������仯��ͼ��ʾ������˵���д������
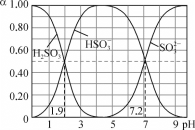
A. 1gK1��H2SO3������1.9
B. pH��3ʱ��c��HSO3������c��H2SO3����c��SO32����
C. ��ӦH2SO3��SO32��![]() 2HSO3����lgK��5.3
2HSO3����lgK��5.3
D. pH��7.2ʱ��c��HSO3������c��SO32������c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������β���ŷų���SO2��NOx�ȣ����γ���������Ҫ���ء������ɿ����еĻҳ������ᡢ���ᡢ�л�̼�⻯����������γɵ�������
��1��NOx��SO2�ڿ����д�������ƽ�⣺2NO(g) + O2(g) ![]() 2NO2(g) ��H= -113.0 kJ��mol-1��2SO2(g)+ O2 (g)
2NO2(g) ��H= -113.0 kJ��mol-1��2SO2(g)+ O2 (g) ![]() 2SO3(g) ��H=-196.6 kJ��mol-1��SO2ͨ���ڶ��������Ĵ����£���һ��������������SO3��
2SO3(g) ��H=-196.6 kJ��mol-1��SO2ͨ���ڶ��������Ĵ����£���һ��������������SO3��
�� д��NO2��SO2��Ӧ���Ȼ�ѧ����ʽΪ__________________________��
�� ���¶����ߣ��÷�Ӧ��ѧƽ�ⳣ���仯������____________���������С�����䡱��
��2�����2SO2 + O2![]() 2SO3��Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3��Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
�� T�¶�ʱ����1L���ܱ������м���2.0 mol SO2��1.0 mol O2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%�����¶��·�Ӧ��ƽ�ⳣ��K=_______��
�� �ڢ��������£���Ӧ�ﵽƽ��ı�������������ʹSO2��ת������ߵ���_________������ĸ����
a���¶Ⱥ�����������䣬����1.0 mol He b���¶Ⱥ�����������䣬����1.0 mol O2
c����������������ʱ��������������� d����������������ʱ��������ϵ�¶�
��3������β���ǵ��������һ����Ҫ��Դ������������NO�ķ�ӦΪ��N2 (g) + O2 (g) ![]() 2NO(g) ��H>0
2NO(g) ��H>0
���������������¶�Խ�ߣ���λʱ����NO���ŷ���Խ����ԭ����_______________��
��4���о���Ա������β��ϵͳ��װ�ô�ת����������Ч����NOx���ŷš�
�� д����CO��ԭNO����N2�Ļ�ѧ����ʽ____________________��
�� ��ʵ������ģ�´˷�Ӧ����һ�������µ��ܱ������У����NOת��ΪN2��ת�������¶ȱ仯�����n (NO)/n(CO)�����仯�������ͼ��
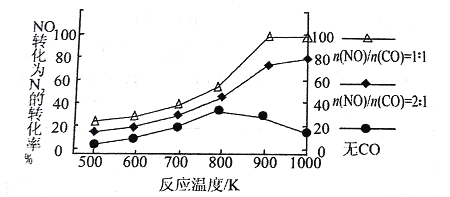
Ϊ�ﵽNOת��ΪN2�����ת���ʣ�Ӧ��ѡ�õ��¶Ⱥ�n(NO)/n(CO)�����ֱ� Ϊ________��________���÷�Ӧ��H________0�����������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com