
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是
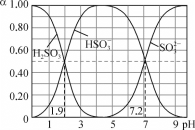
A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是可被细菌作为碳源和能源利用的聚合物,属于一种生物可降解高分子材料,在食品、药品包装方面具有独特优势。已知A~G均为有机化合物,以下为高分子化合物G的一种合成路线:
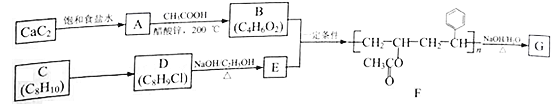
回答以下问题:
(1)由CaC2制备A的化学方程式为_________________________________。
(2)A生成B的反应类型为______________________。
(3)C的化学名称是___________,C→D所需试剂和条件分别是___________、___________。
(4)E的结构简式为______________________。
(5)芳香族化合物H是D的同分异构体,则H可能的结构共有___________种(不包括D),写出核磁共振氢谱有三组峰且峰面积之比为1︰2︰6的H的同分异构体的结构简式___________(任写一种)。
(6)由F生成G的化学方程式为_________________________________。
(7)参考题中信息,设计由1,2二氯乙烷和冰醋酸为原料制取![]() 的合成线路图(无机试剂任选)__________________。
的合成线路图(无机试剂任选)__________________。
已知:-OH与碳碳双键两端的碳原子直接相连不稳定,会自变成—CHO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4·H2O,其主要实验流程如下:

已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(深蓝色);③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85 ℃条件下进行,适宜的加热方式为________。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为________________________。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是___________。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响

(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4·H2O的实验、操作为___________。

(4)滤液1和滤液2中含一定量的Cu2+、Zn2+。为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的________(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10-21。测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在)的浓度分别为1.15 g·L-1、0.58 g·L-1,可采用“氧化中和共沉淀”法除去,请设计实验方案: ____________________________(实验中须使用的试剂有:30%双氧水,0.001 mol·L-1K3[Fe(CN)6]溶液,回收的铜锌沉淀物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq) ![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________

A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了延长水果的保鲜期,下列的水果存放方法最合适的是
A.放入敞口的容器中 B.放入浸泡过高锰酸钾溶液硅土的密封容器中
C.放入密封的容器中 D.放入充有少量乙烯的密封容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.6 g H2O的物质的量是____,含有水分子的数目是_____,含有氢原子的物质的量是_____。
(2)1.5molCO2和______g CH4在标准状况下占有相同的体积,其体积为________。
(3)在标准状况下,100mL某气体的质量为0.179g,该气体的相对分子质量为________。
(4)现有mg某X2气体,它的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则:该气体的物质的量为______mol;一个X原子的质量为_______g;该气体在标准状况下的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com