
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g) + O2(g) ![]() 2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
2SO3(g) △H = -196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 前5 min的平均反应速率为υ(SO2) = 0.08 mol/(L·min)
B. 保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g)时,υ正> υ逆
C. 相同温度下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为40%
D. 保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ 的热量
【答案】C
【解析】
根据第10、15分钟SO2和O2的量确定此时反应达到平衡。
A.前5min的平均速率为v(SO2)=(2-1.2)÷2÷5=0.08mol·L1min1,故A正确;
B.保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和0.2 mol SO3(g),反应正向进行,v(正)>v(逆),故B正确;
C.相同温度下,起始时向容器中充入2mol SO3与上述平衡为等效平衡,SO3的转化率为40%,现加入1.5mol SO3,压强减少,平衡向气体分子数增大的方向移动,SO3的转化率大于40%,故C错误;
D.此情况与上述平衡为等效平衡,生成0.8mol SO2,根据反应2SO3(g)![]() 2SO2(g)+O2(g) H=+196kJ·moL1可知,达到平衡状态时吸收的热量196÷2×0.8=78.4kJ,故D正确。
2SO2(g)+O2(g) H=+196kJ·moL1可知,达到平衡状态时吸收的热量196÷2×0.8=78.4kJ,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的数字表示一种短周期元素,回答下列问题:

(1)画出③的原子结构示意图:____________________。
(2)③、④、⑦、⑧四种元素所形成的气态氢化物中最稳定的是__________(填化学式)。
(3)①在元素周期表中的位置是____________________________。
(4)⑧、⑨元素的最高价氧化物对应水化物的酸性:____>____(用化学式表示)。_________
(5)由③、⑤和⑩组成的化合物所含化学键类型为__________,电子式为____________。
(6)④、⑤、⑥的原子半径由大到小的顺序是:____>____>____(用元素符号表示)。__________
(7)⑥单质与氢氧化钠溶液反应的化学方程式是__________________________________。
(8)已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为上表中元素组成。
①A的浓溶液与甲能发生如下图所示的反应。
②甲是常见的黑色固体单质,可为生产生活提供热能。
③乙是常见的无色气体单质。
④B是无色有刺激性气味的气体,是主要的大气污染物之一。
⑤常温下,C是一种无色液体。

回答问题:
①写出下列物质的化学式:A_____,E_____,G_____。
②写出下列反应的化学方程式:
C+E→F+乙________________________________。
B+C+乙→A________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是
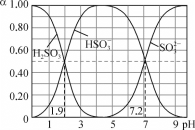
A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
A. 溶液中导电粒子的数目增加,导电性增强
B. 醋酸的电离程度增大,pH增大
C. 再加入10mLpH=11NaOH溶液,混合液pH>7
D. 溶液中c(CH3COO—)/c(CH3COOH)c(OH—)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Co3O4是一种电极材料,可用草酸盐湿式沉淀—煅烧分解法制备。
(1)先用(NH4)2C2O4溶液和CoCl2溶液为原料制取难溶于水的CoC2O4·2H2O晶体。
①已知25 ℃,Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。(NH4)2C2O4溶液的pH__ (填“>”“=”或“<”)7。
②反应时,使(NH4)2C2O4过量的原因是________________________。
(2) 为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575 g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385 ℃以上残留固体均为金属氧化物)

①B处的物质为________(填化学式)。
②经测定,205~385 ℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积。(写出计算过程,结果保留2位有效数字) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
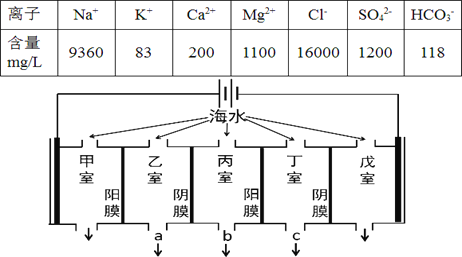
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com