
【题目】下列关于![]() (螺[2,2]戊烷)的说法正确的是
(螺[2,2]戊烷)的说法正确的是
A. 一氯代物的结构只有一种
B. 与戊烯互为同分异构体
C. 所有碳原子均处同一平面
D. 能使酸性高锰酸钾溶液褪色
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。(用Q1 、Q2表示)
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3 ,500℃时充分反应达平衡后,吸收热量Q3 kJ,则Q1、Q2、Q3 之间满足何种关系:Q3=____________。
(4)能说明该反应已经达到平衡状态的是_______
A.v(C3)=2v(B2) B.容器内压强保持不变
C.A2 与 B2 的转化率相等 D.容器内的气体密度保持不变
(5)改变某一条件,得到如图所示的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________(填序号)

A.反应速率:c>b>a B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
(6)若将上述容器改为恒压容容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A. 在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B. 用碱式滴定管移取25.00 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C. 在天平上准确称取烧碱样品2.0 g,在烧杯中用蒸馏水溶解;
D. 将物质的量浓度为0.100 0 mol·L-1的标准盐酸装入酸式滴定管,调整液面记下开始读数为V1;
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2。
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写)
________→________→________→D→________。
(2)上述E中锥形瓶下垫一张白纸的作用是_______________________________
(3)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到加入一滴盐酸后,溶液____________________________ (填颜色变化)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____________)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(6)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前 刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该烧碱的纯度____。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中生成白色沉淀的化学方程式:____。
(3)硬质玻璃管中的反应现象为__,反应的化学方程式为___。
(4)装置中空试管的作用是____。
(5)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出木炭与浓硫酸反应的化学方程式____。
为了验证产物中的二氧化碳气体,甲、乙两同学分别设计如下实验(已知Br2+2H2O+SO2=H2SO4+2HBr):
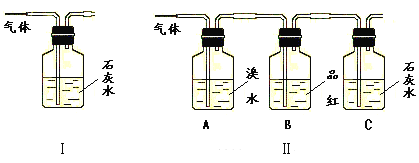
请回答下列问题:
(1)能否根据Ⅰ装置中石灰水变浑浊的现象说明产物中一定有二氧化碳气体?___,理由是____。
(2)Ⅱ装置中A的作用是___;B的作用是___。
(3)根据B中品红__,C中产生___,说明产物中一定有二氧化碳气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)21世纪是钛的世界,钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:

I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是_______
III.用TiCl4制备TiO2·xH2O的化学方程式为________________,制备时需要________,促进水解趋于完全。
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在________(填仪器名称)中加热。
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式_________________________________________________,AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
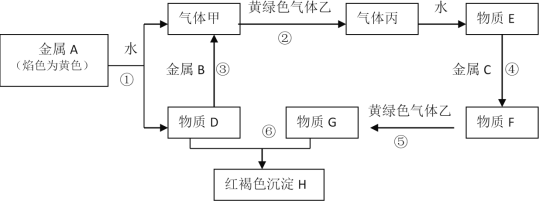
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___、 B___、C___、F___、H___、乙___。
(2)写出下列反应化学方程式:
反应⑤____。
反应⑥____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的数字表示一种短周期元素,回答下列问题:

(1)画出③的原子结构示意图:____________________。
(2)③、④、⑦、⑧四种元素所形成的气态氢化物中最稳定的是__________(填化学式)。
(3)①在元素周期表中的位置是____________________________。
(4)⑧、⑨元素的最高价氧化物对应水化物的酸性:____>____(用化学式表示)。_________
(5)由③、⑤和⑩组成的化合物所含化学键类型为__________,电子式为____________。
(6)④、⑤、⑥的原子半径由大到小的顺序是:____>____>____(用元素符号表示)。__________
(7)⑥单质与氢氧化钠溶液反应的化学方程式是__________________________________。
(8)已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为上表中元素组成。
①A的浓溶液与甲能发生如下图所示的反应。
②甲是常见的黑色固体单质,可为生产生活提供热能。
③乙是常见的无色气体单质。
④B是无色有刺激性气味的气体,是主要的大气污染物之一。
⑤常温下,C是一种无色液体。

回答问题:
①写出下列物质的化学式:A_____,E_____,G_____。
②写出下列反应的化学方程式:
C+E→F+乙________________________________。
B+C+乙→A________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com