
【题目】以下是两种有机物的球棍模型:![]() 代表H原子,
代表H原子,![]() 代表C原子,请回答下列问题:
代表C原子,请回答下列问题:
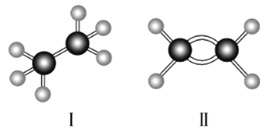
(1)Ⅰ的分子式为________,Ⅱ的结构简式为________。
(2)由Ⅱ变成Ⅰ的化学反应类型为________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)向K2CO3溶液中滴加酚酞,观察到的现象____________________,产生这种现象的原因是(用离子方程式回答)___________________________________________若将此溶液微热,观察到的现象________________________________,原因是__________________________________
(2)向K2CO3溶液中加入AlCl3溶液,反应的离子方程式是__________________________
(3)将K2CO3溶液蒸干得到的物质是______________________ 若将KHCO3溶液蒸干灼烧得到的物质是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期的元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,常温下,0.010ml/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法错误的是

A. 简单离子半径:Y>Z>W>X
B. Y元素存在同素异形体
C. 气态氢化物的稳定性:Y>Z>W
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的混合液②含有泥沙的食盐水③溶有碘(I2)的氯化钾溶液④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见表)。
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
乙二醇 | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用如图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )

A. ①—c—分液B. ②—a—萃取
C. ③—c—萃取D. ④—a—蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 把100mL3mo/LH2SO4溶液与100mL1mo/LBaCl2溶液混合,所得溶液c(SO42-)变为1mol/L
B. 把200mL3mol/LBaCl2溶液与100mL3mol/LKCl 溶液混合后,所得溶液c(Cl-)仍为3mol/L
C. 把100mL20%的NaOH溶液与100mLH2O混合后,所得溶液中NaOH的质量分数为10%
D. 把100g20%的NaCl溶液与100mLH2O混合后,所得溶液中NaCl的质量分数为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素的+6价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:Fe3+完全沉淀[c(Fe3+)≤1.0×10-5mol·L-1时pH为3.6。
回答下列问题:
(1)滤渣A的主要成分为___________。
(2)根据右图信息,操作B包含蒸发结晶和___________。

(3)酸化后的Cr2O72-可被SO32-还原,该反应中若有0.5mol Cr2O72-被还原为Cr3+,则消耗SO32-的物质的量为___________mol。
(4)将重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠可以制得工业用粗化液的主要成分CrO3(铬酐),写出该反应的化学方程式______________________。
(5)通过两步反应可以实现Cr(OH)3转化为Cr,若第一步反应为2Cr(OH)3![]() Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
(6)利用如图装置,探究铬和铁的活泼性强弱。能证明铁比铬活泼的实验现象是______________________。工业上,在钢器具表面镀铬以增强器具的抗腐蚀性能,用硫酸铬[Cr2(SO4)3]溶液作电解液,阴极的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应: N2(g)+3H2(g)![]() 2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A. 该反应达平衡时H2的转化率为40%
B. 降低温度能使混合气体的密度增大
C. 向该容器中充入N2,平衡正向移动
D. 研发高效催化剂可大大提高N2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com