
【题目】铬元素的+6价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:Fe3+完全沉淀[c(Fe3+)≤1.0×10-5mol·L-1时pH为3.6。
回答下列问题:
(1)滤渣A的主要成分为___________。
(2)根据右图信息,操作B包含蒸发结晶和___________。

(3)酸化后的Cr2O72-可被SO32-还原,该反应中若有0.5mol Cr2O72-被还原为Cr3+,则消耗SO32-的物质的量为___________mol。
(4)将重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠可以制得工业用粗化液的主要成分CrO3(铬酐),写出该反应的化学方程式______________________。
(5)通过两步反应可以实现Cr(OH)3转化为Cr,若第一步反应为2Cr(OH)3![]() Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
(6)利用如图装置,探究铬和铁的活泼性强弱。能证明铁比铬活泼的实验现象是______________________。工业上,在钢器具表面镀铬以增强器具的抗腐蚀性能,用硫酸铬[Cr2(SO4)3]溶液作电解液,阴极的电极反应式为______________________。

【答案】Fe(OH)3 趁热过滤 1.5mol Na2Cr2O7+2H2SO4(浓) ![]() 2NaHSO4+2CrO3+H2O Cr2O3+2Al
2NaHSO4+2CrO3+H2O Cr2O3+2Al ![]() Al2O3+2Cr Cr电极上产生气泡,溶液颜色变为浅绿色 Cr3++3e-=Cr
Al2O3+2Cr Cr电极上产生气泡,溶液颜色变为浅绿色 Cr3++3e-=Cr
【解析】
(1)加入NaOH至溶液的pH=3.6时Fe3+形成Fe(OH)3沉淀进入滤渣A中;
(2)根据物质的溶解度与温度变化关系采用高温过滤分离Na2SO4、Na2Cr2O7;
(3)根据在溶液中 Cr2O72-、SO32-发生氧化还原反应,电子得失数目相等计算;
(4)重铬酸钠与浓硫酸在加热时反应产生硫酸氢钠、CrO3和水,根据原子守恒配平方程式;
(5)Cr2O3与Al在高温下发生置换反应,产生Cr与Al2O3,根据电子守恒、原子守恒配平方程式;
(6)利用原电池反应原理,比较金属的活泼性,活动性强的为负极,失去电子,发生氧化反应;活动性弱的为正极,正极上发生还原反应;在电镀时,镀件钢器具作阴极,发生还原反应。
(1)铬渣中含有Na2SO4及少量Cr2O72-、Fe3+,先水浸,然后向其中加入稀的NaOH溶液,调整pH=3.6,这时Fe3+完全转化为Fe(OH)3沉淀进入滤渣A中,故滤渣A主要成分是Fe(OH)3;
(2)将滤渣A过滤除去后溶液中含有Na2SO4、Na2Cr2O7,将溶液蒸发浓缩,根据物质的溶解度曲线可知:Na2Cr2O7的溶解度随温度的升高而增大,Na2SO410H2O的溶解度先是随温度的升高而增大,当温度接近50℃时,Na2SO4的溶解度随温度的升高而减小,趁热过滤,就可以使Na2SO4过滤除去,得到的母液中主要含有Na2Cr2O7;因此操作是蒸发浓缩、趁热过滤;
(3)酸化后的Cr2O72-可被SO32-还原,根据电子得失数目相等可知,若该反应中有0.5mol Cr2O72-被还原为Cr3+,转移电子的物质的量为n(e-)=0.5mol×2×(6-3)=3mol,由于SO32-被氧化为SO42-,每1mol SO32-失去2mol电子,所以消耗SO32-的物质的量n(SO32-)=3mol÷2=1.5mol;
(4)重铬酸钠与浓硫酸在加热时反应产生硫酸氢钠、CrO3和水,根据反应前后各种元素的原子守恒,可得反应方程式:Na2Cr2O7+2H2SO4(浓)![]() 2NaHSO4+2CrO3+H2O;
2NaHSO4+2CrO3+H2O;
(5)Cr2O3与Al在高温下发生置换反应,产生Cr与Al2O3,根据电子守恒、原子守恒配平方程式为:Cr2O3+2Al ![]() Al2O3+2Cr;
Al2O3+2Cr;
(6)若要利用原电池反应原理,证明铁比铬活泼,可以将二者连接起来,放入稀H2SO4中,在Fe电极上发生反应:Fe-2e-=Fe2+,进入溶液,使溶液变为浅绿色;电子经过导线转移至金属Cr上,溶液中的H+在Cr上获得电子,发生还原反应:2H++2e-=H2↑,在Cr电极上有许多气泡产生。因此看到实验现象是:溶液颜色变为浅绿色,同时在Cr电极上有许多气泡产生;在钢器具表面镀铬,要使钢器具与外接电源的负极连接,作阴极,发生还原反应:Cr3++3e-=Cr,使钢铁表面覆盖一层金属铬,抗腐蚀能力大大增强。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(s)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的
2Z(g)一定达到化学平衡状态的
①容器中气体的密度不再发生变化 ②Y的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成2mol Z,同时消耗2mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是两种有机物的球棍模型:![]() 代表H原子,
代表H原子,![]() 代表C原子,请回答下列问题:
代表C原子,请回答下列问题:
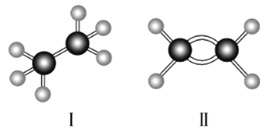
(1)Ⅰ的分子式为________,Ⅱ的结构简式为________。
(2)由Ⅱ变成Ⅰ的化学反应类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2NO2(红棕色)![]() N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )
N2O4(无色) ΔH<0。将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列说法不正确的是( )

A. b点达到了平衡状态
B. b点对应的时刻改变的条件是将注射器的活塞向外拉
C. d点:v(正)<v(逆)
D. 若在c点将温度降低,其透光率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应X(g)+3Y(g)2Z(g)达化学平衡状态的标志是
A. Z的生成速率与Z的分解速率相等
B. 单位时间生成amolX,同时生成3a molY
C. X、Y、Z的浓度相等
D. X、Y、Z的分子数比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com