
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】铬元素的+6价化合物毒性较大,不能随意排放。某化工厂以铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠,同时制备金属铬的工艺流程如下:

已知:Fe3+完全沉淀[c(Fe3+)≤1.0×10-5mol·L-1时pH为3.6。
回答下列问题:
(1)滤渣A的主要成分为___________。
(2)根据右图信息,操作B包含蒸发结晶和___________。

(3)酸化后的Cr2O72-可被SO32-还原,该反应中若有0.5mol Cr2O72-被还原为Cr3+,则消耗SO32-的物质的量为___________mol。
(4)将重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠可以制得工业用粗化液的主要成分CrO3(铬酐),写出该反应的化学方程式______________________。
(5)通过两步反应可以实现Cr(OH)3转化为Cr,若第一步反应为2Cr(OH)3![]() Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
Cr2O3+3H2O;第二步反应利用了铝热反应原理,则该反应方程式为___________。
(6)利用如图装置,探究铬和铁的活泼性强弱。能证明铁比铬活泼的实验现象是______________________。工业上,在钢器具表面镀铬以增强器具的抗腐蚀性能,用硫酸铬[Cr2(SO4)3]溶液作电解液,阴极的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在制蒸馏水的实验中,下列叙述正确的是( )
A. 在蒸馏烧瓶中盛约![]() 体积的自来水,并放入几粒沸石
体积的自来水,并放入几粒沸石
B. 将温度计插入液面以下,以随时测定烧瓶中液体的温度
C. 冷水从冷凝管上口入,下口出
D. 收集蒸馏水时,从开始馏出液体就收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应: N2(g)+3H2(g)![]() 2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
2NH3(g);△H<0。10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A. 该反应达平衡时H2的转化率为40%
B. 降低温度能使混合气体的密度增大
C. 向该容器中充入N2,平衡正向移动
D. 研发高效催化剂可大大提高N2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物、岩石的成因和变化受多种条件的影响。地壳内每加深1![]() ,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g)
,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g) ![]() SiF4(g)+2H2O(g) + 148.9KJ
SiF4(g)+2H2O(g) + 148.9KJ
根据题意完成下列填空:
(1)该反应的△H________0,在地壳深处容易有____________气体逸出,已知此处温度较高,则该反应为 _____________反应(填“自发”,“非自发”,“无法确定”)
(2)如果上述反应的平衡常数K值变大,该反应__________(填编号)。
A.一定向正反应方向移动
B.正逆反应速率一定加快
C.平衡移动过程为:正反应速率先增大后减小
D.平衡移动过程为:逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应已经达到平衡时,下列成立的是_______ (填编号)。
a.2 v正(HF) = v逆(H2O) b. v (H2O) = 2v (SiF4)
c. SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答有关问题。
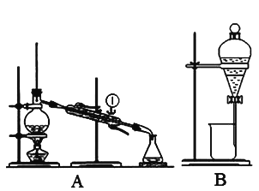

(1)装置A中①的仪器名称是____________。利用装置B分液时为使液体顺利滴下,应进行的具体操作是____________。
(2)从氯化钾溶液中得到氯化钾固体,应选择装置__________(填字母,下同);除去自来水中的![]() 等杂质,应选择装置________。
等杂质,应选择装置________。
(3)从碘水中分离出![]() ,应选择装置_____________,该分离方法的名称为____________。
,应选择装置_____________,该分离方法的名称为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:

(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。

②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验。请完成下列填空:
(1)配制500mL 0.1000mol·L-1 NaOH 标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、__________、__________等。
②称取__________g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、__________
(2)取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用__________(填仪器名称)盛装配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
滴定次数 | 待测盐酸 的体积/mL | 标准NaOH溶液体积 | |
滴定前的刻度/mL | 滴定后的刻度/rnL | ||
第一次 | 20.00 | 0.40 | 20.50 |
第二次 | 20.00 | 4.10 | 24.00 |
第三次 | 20.00 | 1.00 | 24.00 |
(3)①如何判断滴定终点:____________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________mol·L-1。
③排去碱式滴定管中气泡的方法应采用下图操作中的__________(填序号),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定果偏低的有__________(填序号)。
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
D.滴定终点读数时俯视读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是
A.2Na+2H20=2Na0H+H2↑ B.C12+H20=HC1+HC10
C.2F2+2H20=4HF+02 D.2H20![]() 2H2↑+02↑
2H2↑+02↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com