
【题目】自然界的矿物、岩石的成因和变化受多种条件的影响。地壳内每加深1![]() ,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g)
,压强增大约25000~30000KPa,温度升高25—30摄氏度。在地壳内SiO2和HF存在以下平衡: SiO2(s)+4HF(g) ![]() SiF4(g)+2H2O(g) + 148.9KJ
SiF4(g)+2H2O(g) + 148.9KJ
根据题意完成下列填空:
(1)该反应的△H________0,在地壳深处容易有____________气体逸出,已知此处温度较高,则该反应为 _____________反应(填“自发”,“非自发”,“无法确定”)
(2)如果上述反应的平衡常数K值变大,该反应__________(填编号)。
A.一定向正反应方向移动
B.正逆反应速率一定加快
C.平衡移动过程为:正反应速率先增大后减小
D.平衡移动过程为:逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应已经达到平衡时,下列成立的是_______ (填编号)。
a.2 v正(HF) = v逆(H2O) b. v (H2O) = 2v (SiF4)
c. SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为_____________。
【答案】< SiF4和H2O 非自发 AD bc 0.001mol·L-1·min-1
【解析】
(1)该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)和H2O(g)逸出;减小压强有SiO2(s)沉淀析出;故在地壳深处容易有SiF4、H2O气体逸出;
(2)化学平衡常数只随温度的变化而变化,该反应为放热反应,平衡常数K值变大说明温度降低平衡右移,温度降低反应速率减小,平衡右移逆反应速率增大;
(3)达到平衡时,正逆反应速率相等,用不同物质表示的速率之比等于化学计量数之比;
(4)根据v(HF)=C/t计算。
(1)由SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ可知,该反应为放热反应,故△H<0;该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)和H2O(g)逸出;减小压强有SiO2(s)沉淀析出;故在地壳深处压强很高,故容易有SiF4、H2O气体逸出;在较高温度下,ΔG=ΔH-TΔS>0,反应不能自发进行;根据故答案为:<,SiF4、H2O,非自发。
(2)化学平衡常数只随温度的变化而变化,该反应为放热反应,平衡常数K值变大,说明温度降低平衡右移,温度降低反应速率减小,平衡右移过程中正反应速率减小、逆反应速率增大,故A、D正确,故答案为:AD。
(3)达到平衡时,正逆反应速率相等,用不同物质表示的速率之比等于化学计量数之比,v(H2O) =2v(SiF4),各物质的量保持不变,但反应仍在进行,综上所述,b,c正确,故答案为:bc。
(4)由容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,
则增加的质量为2.0L×0.12g/L=0.24g,由反应及元素守恒可知,每4molHF反应气体质量增加28+16×2=60g,
设参加反应的HF的物质量为x,
SiO2(s)+4HF(g)SiF4(g)+2H2O(g)△m
4mol 1mol 2mol 60g
x 0.24g
4mol / x =60g/0.24g,解得x=0.016mol,
v(HF)=C/t=0.016mol/2L×8.0min=0.0010mol/(Lmin)
故答案为:0.0010mol/(Lmin)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
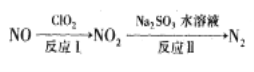
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____(填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8molL﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题: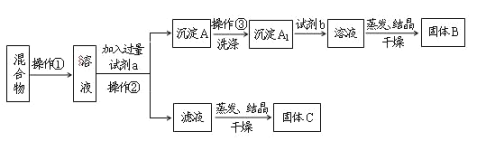
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)试剂a是____,试剂b是___。
(2)加入试剂a所发生反应的化学方程式为____,加入试剂b所发生反应的化学方程式为_____。
(3)该方案能否达到实验目的:____(填“能”或“不能”)若不能,应如何改进?(若能,此问不用回答_____。
(4)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A. c(H+) +c(HSO3-) +2c(H2SO3) =c(OH-)
B. c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C. c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D. 升高温度,溶液pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙罗特美是一种长效平喘药,其合成的部分路线如下:
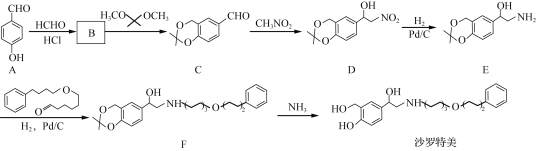
(1)F中的含氧官能团名称为____________(写两种)。
(2)C→D的反应类型为____________。
(3)B的分子式为C8H8O3,与(CH3)2C(OCH3)2发生取代反应得到物质C和CH3OH,写出B的结构简式:________。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:__________。
①分子中含有苯环,且有一个手性碳原子,不能与FeCl3发生显色反应;
②能发生水解反应,水解产物之一是α氨基酸,另一含苯环的水解产物分子中只有3种不同化学环境的氢。
(5)请写出以 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作。回答下列问题:

(1)试剂Ⅰ的化学式为_______。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是除去A中的____,检验该离子已经除尽的方法是________________________________________________________。
(3)③中发生反应的化学方程式为_________________________________________________。
(4)由E得到KCl晶体的实验操作是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com