
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���KCl��BaCl2���ֹ�������Իش��������⣺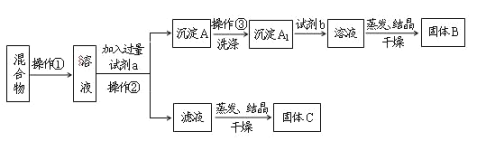
��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
��1���Լ�a��____���Լ�b��___��
��2�������Լ�a��������Ӧ�Ļ�ѧ����ʽΪ____�������Լ�b��������Ӧ�Ļ�ѧ����ʽΪ_____��
��3���÷����ܷ�ﵽʵ��Ŀ�ģ�____���������������������������ܣ�Ӧ��θĽ��������ܣ����ʲ��ûش�_____��
��4����Ҫ�ⶨԭ�������BaCl2����������������Ҫȷ���������������⣬���ٻ�Ҫ��õ�������____��������
���𰸡�K2CO3 HCl K2CO3��BaCl2=BaCO3����2KCl BaCO3��2HCl=BaCl2��CO2����H2O ��(����) Ӧ�ڲ����ڵ���Һ�м������������������ᾧ ����A1�����B
��������
����KCl��BaCl2���ֹ��������������ˮ��Ȼ��������K2CO3ʹBaCl2ת��Ϊ���������˺�����������������BaCl2��Һ�����������ᾧ�������ɵù���BaCl2��������������ҺΪKCl��K2CO3�Ļ��������ᾧ�õ�����CΪKCl��K2CO3��Ӧ�����������ɵ�KCl������AΪBaCO3��ϴ�Ӻ����ᣬ�����õ�����BΪBaCl2��
��1��������Ϊ�����Һ��ķ��룬Ϊ���˲����������ܽ��������K2CO3ʹBaCl2ת��Ϊ���������Լ�aΪK2CO3��BaCO3+2H��=Ba2��+CO2��+H2O�������Լ�b��BaCO3����ת��ΪBaCl2��Һ���Լ�bΪ���
��2�������Լ�a��������Ӧ�Ļ�ѧ����ʽΪ K2CO3��BaCl2=BaCO3����2KCl�������Լ�b��������Ӧ�Ļ�ѧ����ʽΪBaCO3��2HCl=BaCl2��CO2����H2O��
��3���÷������ܴﵽʵ��Ŀ�ģ�������������ҺΪKCl��K2CO3�Ļ��������ᾧ�õ�����CΪKCl��K2CO3��Ӧ�����������ɵ�KCl����Ӧ�ڲ����ڵ���Һ�м������������������ᾧ��
��4���ⶨ�Ȼ����������������ɼ���̼�ᱵ�������Ȼ��������������õ�����A1�����B��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��������ȷ����

A. ͼ�ٿɱ�ʾ������ͨ�������Һ��������������Һ�����Եı仯
B. ����ͼ�ڿ��жϿ��淴ӦA2(g)+3B2(g)![]() 2AB3(g)����H��0
2AB3(g)����H��0
C. ͼ�۱�ʾ���������pH�������������Һ�ֱ���������п�۷�����Ӧ�������������(V)��ʱ�ı仯��ʾ��ͼ
D. ͼ�ܿɱ�ʾѹǿ�Կ��淴ӦA(g)+B(g)![]() 2C(g)+D(g)��Ӱ�죬�ҵ�ѹǿ��
2C(g)+D(g)��Ӱ�죬�ҵ�ѹǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ��ʵ���У�����������ȷ���ǣ� ��
A. ��������ƿ��ʢԼ![]() ���������ˮ�������뼸����ʯ
���������ˮ�������뼸����ʯ
B. ���¶ȼƲ���Һ�����£�����ʱ�ⶨ��ƿ��Һ����¶�
C. ��ˮ���������Ͽ��룬�¿ڳ�
D. �ռ�����ˮʱ���ӿ�ʼ���Һ����ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����0.200 0 mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£�
��������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ�
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ��촦����Һ�壻
�۵���Һ������0������0���̶������£������¶�����
����ȡ20.00 mL����Һע��ྻ�Ļ�������������ˮ����ƿ�У�������3�η�̪��Һ��
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
��ش��������⣺
��1�����ϲ����д������______(����)�����ⶨ���ƫ�ߣ���ԭ�������________(����ĸ)��
A.���Ʊ���Һ�Ĺ���NaOH�л���KOH����
B.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C.ʢװδ֪Һ����ƿ������ˮϴ��������δ֪Һ��ϴ
D.����ı�NaOH��Һ���ʵ���Ũ��ƫ��
��2���жϵζ��յ��������_____________________________________��
��3����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ________mL��

��4�������������ݣ��������������Ũ�ȣ�________mol��L��1��
�ζ����� | �������(mL) | ���ռ���Һ���(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 20.00 | 0.40 | 20.40 |
�ڶ��� | 20.00 | 2.00 | 24.10 |
������ | 20.00 | 4.00 | 24.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���Ϊ2L�ĺ����ܱ����������1 mol N2��4 molH2����һ���¶��·�����Ӧ�� N2��g��+3H2��g��![]() 2NH3��g������H<0��10���ﵽƽ�⣬c��NH3��Ϊ0.4mol/L������˵����ȷ����
2NH3��g������H<0��10���ﵽƽ�⣬c��NH3��Ϊ0.4mol/L������˵����ȷ����
A. �÷�Ӧ��ƽ��ʱH2��ת����Ϊ40%
B. �����¶���ʹ���������ܶ�����
C. ��������г���N2��ƽ�������ƶ�
D. �з���Ч�����ɴ�����N2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ��Ŀ����ʯ�ij���ͱ仯�ܶ���������Ӱ�졣�ؿ���ÿ����1![]() ,ѹǿ����Լ25000~30000KPa���¶�����25��30���϶ȡ��ڵؿ���SiO2��HF��������ƽ��: SiO2(s)+4HF(g)
,ѹǿ����Լ25000~30000KPa���¶�����25��30���϶ȡ��ڵؿ���SiO2��HF��������ƽ��: SiO2(s)+4HF(g) ![]() SiF4(g)+2H2O(g) + 148.9KJ
SiF4(g)+2H2O(g) + 148.9KJ
������������������:
��1���÷�Ӧ�ġ�H________0���ڵؿ��������____________�����ݳ�����֪�˴��¶Ƚϸߣ���÷�ӦΪ _____________��Ӧ����Է����������Է���������ȷ������
��2�����������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ__________(����)��
A.һ��������Ӧ�����ƶ�
B.���淴Ӧ����һ���ӿ�
C.ƽ���ƶ�����Ϊ������Ӧ������������С
D.ƽ���ƶ�����Ϊ���淴Ӧ�����ȼ�С������
��3�����������Ӧ�����������ܱ������з���������Ӧ�Ѿ��ﵽƽ��ʱ�����г�������_______ (����)��
a.2 v��(HF) = v��(H2O) b. v (H2O) = 2v (SiF4)
c. SiO2���������ֲ��� d.��Ӧ�ﲻ��ת��Ϊ������
��4������Ӧ�����ݻ�Ϊ2.0L����Ӧʱ��8.0min��������������ܶ�������0.12g/L�������ʱ����HF��ƽ����Ӧ����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮFeCl2����ʪ���ױ�����������Ϊ����ѹ���͵ijɷ֡�ijʵ��С��������ˮFeCl3���ȱ�����ɫҺ�壬�е�132.2�棩�Ʊ�������ˮFeCl2�����ⶨ��ˮFeCl2�IJ��ʡ�
ʵ��ԭ����2FeCl3��C6H5Cl![]() 2FeCl2��C6H4Cl2��HCl��
2FeCl2��C6H4Cl2��HCl��
ʵ��װ�ã�����ͼ��ʾ��װ�õ�װ�ã���������Ժ���������ƿA�м���16.76g��ˮFeCl3��22.5g�ȱ���
�ش��������⣺

��1�����ù�ҵ����������H2O��O2��CO2����ȡ��������ĵ�����
���������װ����ѡ���Ҫ��װ�ã�ȷ�������������˳��a��________����ͼ�е�j�ڣ�������������Сд��ĸ��ʾ����

��ʵ����ɺ�ͨ�뵪������ҪĿ����________��
��2��װ��C�е��Լ���________�����Լ����ƣ�����������________��
��3����������������Լ126�������¾��ҽ���30min�����ϱ�ɺ�ɫ��״������װ��A���ѡ��__������ĸ����
a���ƾ��� b��ˮԡ�� c�����¯ d����ԡ��
��4���������£���128��139�������¼���2h���������ɫ��dz���Ƚ��͡��ò����м����¶��Ѿ��ӽ����ȱ��е㣬���ȱ�ʵ����ʧ��ȴ�dz�С����ԭ����________��
��5����������1h�������ȴ���ڸ������������¹��˳����壬��ϴ�Ӽ����ϴ�����ù��壬��������и���õ���Ʒ����D��������Һǡ����25mL2.0mol��L��1NaOH��Һ��ȫ��Ӧ�����ʵ����FeCl2�IJ���ԼΪ________������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�ؼ��仯����㷺��������Ȼ���С��ش��������⣺
(1)����(COCl2)��һ����Ҫ���л��м��壬��ũҩ��ҽҩ���������ϡ��۰��������Լ������϶���������;�������ķ������幹��Ϊ______________��������Ԫ�صĵ縺����С�����˳��Ϊ______________����COCl2��Ϊ�ȵ�����ķ��Ӻ�����(��дһ��)__________��
(2)�ճ������У�����������ɼ��⣬����ƣ��Դ�ԭ�ӽṹ�ǶȽ�����һ����____________________________��
(3)���־�̬��������ͷǾ�̬����������ɿ��Ŀ�ѧ������_____________��
(4)һ��ͭ���廯�ᄃ���ṹ��ͼ��ʾ������ͼ�е�Cuȥ�����ٰ����е�Br����Cu���õ�����ͭ�ľ����ṹ������ͭ�Ķѻ���ʽΪ___________��ijͬѧ����̬ͭԭ�Ӽ۵��Ӵ����дΪ3d94s2��Υ���˺�������Ų������е�______��
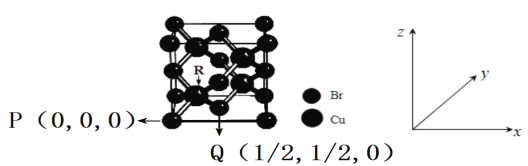
(5)���й�������ͭ���廯�ᄃ���ṹ˵����ȷ����_________(ѡ����ĸ���)��
A���û�����Ļ�ѧʽΪCuBr2
B��ͭ����λ��Ϊ8
C����ÿ��Br���ڵ�Br��12��
D����ͼ��P���Q���ԭ�����������ȷ��R���ԭ���������Ϊ(1/4,1/4,1/4)
(6)��ͼ��P���R���ԭ�Ӻ˼��Ϊa cm��NAΪ����٤��������ֵ����þ����ܶ�Ϊ______g/cm3��(�г�����ʽ����)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com