
【题目】25℃时有甲、乙、丙三种溶液,甲为0.1mol·L-1NaOH溶液,乙为0.1mol·L-1HCl溶液,丙为0.1 mol·L-1CH3COOH溶液,请回答下列问题:
(1)甲溶液的pH=___________________。
(2)乙溶液中由水电离出的c(H+)=___________________mol·L-1。
(3)写出丙的电离方程式_________________________________________________________,其电离平衡常数表达式Ka=___________________。
(4)向丙中加入乙,会_____________(“抑制”或“促进”)丙的电离,c(H+)_____________(填“增大”、“减小”或“不变”), 丙的电离平衡常数Ka_____________(填“增大”、“减小”或“不变”)。
(5)各取25 mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙) ____________V (丙)(填“大于”、“小于”或“等于”)。
【答案】13 1×10-13 CH3COOH ![]() H++CH3COO- c(H+) c(CH3COO-)/c(CH3COOH) 或
H++CH3COO- c(H+) c(CH3COO-)/c(CH3COOH) 或![]() 抑制 增大 不变 大于
抑制 增大 不变 大于
【解析】
(1)根据pH=-lgc(H+)计算;
(2)盐酸抑制水电离,由水电离出的c(H+)=溶液中的c(OH-);
(3)醋酸是弱电解质,部分电离为氢离子和醋酸根离子;根据电离平衡常数的定义书写表达式;
(4)0.1mol·L-1HCl溶液中氢离子浓度大于0.1 mol·L-1CH3COOH;电离平衡常数只与温度有关;
(5)NaCl是强酸强碱盐,其水溶液呈中性,醋酸钠是强碱弱酸盐,其水溶液呈碱性。
(1)0.1mol·L-1NaOH溶液中c(OH-)=0.1mol/L,c(H+)=Kw/ c(OH-)=1×10-13 mol/L, pH=-lgc(H+)=13;
(2)0.1mol·L-1HCl溶液中c(H+)=0.1mol/L、c(OH-)=1×10-13 mol/L,盐酸抑制水电离,所以由水电离出的c(H+)=溶液中的c(OH-)=1×10-13;
(3)醋酸是弱电解质,部分电离为氢离子和醋酸根离子,电离方程式是CH3COOH ![]() H++CH3COO-;其电离平衡常数表达式Ka=c(H+) c(CH3COO-)/c(CH3COOH);
H++CH3COO-;其电离平衡常数表达式Ka=c(H+) c(CH3COO-)/c(CH3COOH);
(4)0.1mol·L-1HCl溶液中氢离子浓度大于0.1 mol·L-1CH3COOH,向醋酸溶液中加入盐酸,c(H+)增大,CH3COOH ![]() H++CH3COO-逆向移动,所以抑制醋酸的电离;电离平衡常数只与温度有关,所以醋酸的电离平衡常数Ka不变;
H++CH3COO-逆向移动,所以抑制醋酸的电离;电离平衡常数只与温度有关,所以醋酸的电离平衡常数Ka不变;
(5)各取25 mL的乙、丙两溶液,加入氢氧化钠溶液,恰好完全反应时消耗氢氧化钠的体积相同,此时溶质分别是NaCl、醋酸钠,NaCl是强酸强碱盐,其水溶液呈中性,醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使醋酸钠溶液呈中性,醋酸应该稍微多些,所以各取25mL的乙、丙两溶液,分别用氢氧化钠中和至pH=7,则消耗氢氧化钠的体积大小关系为V(乙)>V(丙);


科目:高中化学 来源: 题型:
【题目】I. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示部分(条件及物质未标出)。
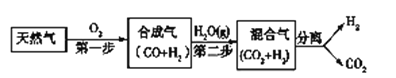
(1)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
P后/P前 | 0.9 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
用H2 表示前2 h平均反应速率v(H2) =__________ mol·(L·h)-1。
(2)在300 ℃、8 MPa下,将二氧化碳和氢气按物质的量之比为1∶3通入一密闭容器中发生(1)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数Kp= ________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
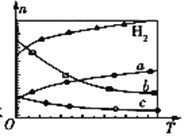
①该反应的ΔH ______ 0 (填“>”、“=”或“<”)。
②曲线c表示的物质为 ____________________。
II. 砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。某小组欲探究可逆反应AsO33-+I2+2OH- ![]() AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
AsO43- + 2I- + H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L的盐酸,发现又产生电流,实验中电流与时的关系如图II所示。
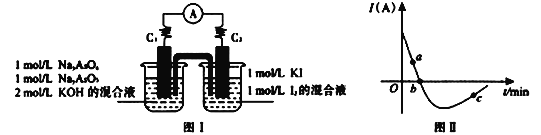
(1)图II中AsO43-的逆反应速率:a____b( 填“>”、“<”或“=” )。
(2)写出图II中c点对应图I装置的正极反应式__________________________。
(3)能判断该反应达到平衡状态的是________。
a.2v(I-)正=v(AsO33-)逆b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案:

下列分析正确的是
A.若m1>m2时,则混合物M中一定含有Al2O3
B.生成蓝色溶液的离子方程式为:Cu+Fe3+=Cu2++Fe2+
C.固体B既可能使纯净物,又可能是混合物
D.要确定混合物M中是否含有Al,可取M加入适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列有关实验叙述正确的是________(填序号)。
a.试管、烧杯均可用于给液体、固体加热
b.使食盐水中NaCl结晶析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
c.用分液漏斗分离水和乙酸混合液
d.分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出
e.用托盘天平称取25.20g氯化钠
f.取用金属钠时,没用完的钠要放回原瓶
(2)实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配制240mL 0.1mol/L的盐酸,应量取浓盐酸体积__mL。使用的仪器除玻璃棒、烧杯、量筒外,还需要_____、____。
(3)在容量瓶使用方法中,下列操作不正确的是(填序号)___。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
F.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2。假设常温下在恒容的密闭容器中发生上述反应,试解答下列问题:
2CO2+N2。假设常温下在恒容的密闭容器中发生上述反应,试解答下列问题:
(1)上述条件下该反应能够自发进行,则反应的ΔH_____0(填写“>”、“<”、“=”)。
(2)能判断该反应达到化学平衡状态的依据是____________。
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1∶1
D.NO、CO、CO2、N2的物质的量之比为2∶2∶2∶1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) ( molL-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO) ( molL-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | X | 2.70×10-3 |
从表中数据分析可知:
①X=____________mol·L-1;
②前2s内的平均反应速率v(N2)=________________________mol·L-1·s-1;
③该温度下反应的平衡常数K=________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是 ( )
A.3Fe + 4H2O(g) ![]() Fe3O4 + 4H2
Fe3O4 + 4H2
B.3NO2 +H2O = 2HNO3+ NO
C.Ca(OH)2+SO2 = CaSO3 + H2 O
D.Cu+2H2SO4 (浓)![]() CuSO4+SO2↑+ 2H2O
CuSO4+SO2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列填空:
(1)当SO2和SO3中分子个数比为1:1 时,原子总数之比为____,质量之比为____。
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是______。
(3)中和含0.2molHCl的稀盐酸,需NaOH的物质的量为_______;如改用KOH,则所需KOH的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的O2和O3所含分子个数比为___,原子个数比为___。
(2)400mL2.0mol/L的Al2(SO4)3溶液中含Al3+的物质的量为___,从中取出10mL,将这10mL溶液用水稀释到100mL,所得溶液中SO42-的物质的量浓度为___。
(3)0.5 molCH4的质量为___;标准状况下,4.48LNH3所含分子数为___。
(4)等物质的量的CH4和N2,所含原子数之比为___,等质量的CH4和N2物质的量之比为___。
(5)3.5molBa(OH)2中含有___个OH-,2.5molNaOH的摩尔质量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中H2、I2各1mol·L-1进行反应H2+ I2![]() 2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
A. 小于30sB. 等于30sC. 大于30sD. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com