
【题目】(1)下列有关实验叙述正确的是________(填序号)。
a.试管、烧杯均可用于给液体、固体加热
b.使食盐水中NaCl结晶析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
c.用分液漏斗分离水和乙酸混合液
d.分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出
e.用托盘天平称取25.20g氯化钠
f.取用金属钠时,没用完的钠要放回原瓶
(2)实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配制240mL 0.1mol/L的盐酸,应量取浓盐酸体积__mL。使用的仪器除玻璃棒、烧杯、量筒外,还需要_____、____。
(3)在容量瓶使用方法中,下列操作不正确的是(填序号)___。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.配置溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
F.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
【答案】f 2.0 250mL的容量瓶 胶头滴管 BCDF
【解析】
(1) 根据实验操作的正确性与规范性分析作答;
(2) 配置240mL溶液需选用250mL的容量瓶,根据c(HCl)=![]() , c1V1=c2V2,进行计算;
, c1V1=c2V2,进行计算;
(3)根据容量瓶的正确使用方法分析。
(1) a.试管可用于给液体、固体加热,烧杯可用于给液体加热,与题意不符,a错误;
b.使食盐水中NaCl结晶析出时,常用到的仪器有蒸发皿、酒精灯、玻璃棒、泥三角、坩埚钳等,与题意不符,b错误;
c.用分液漏斗分离互不相容的液体,水和乙酸相互溶解,与题意不符,c错误;
d.分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗上口倒出,与题意不符,d错误;
e.用托盘天平称取25.2g氯化钠,精确度不对,与题意不符,e错误;
f.取用金属钠时,没用完的钠要放回原瓶,符合题意,f正确;
答案为f;
(2)c(HCl)=1000ρω/M=1000×1.25×36.5%/36.5=12.5mol/L,根据c1×V1=c2×V2,配置240mL溶液需选用250mL的容量瓶,则量取浓盐酸的体积为2.0mL;定容时还需要胶头滴管;
(3) A.使用容量瓶前,必须检查它是否漏水,与题意不符,A错误;
B.容量瓶用蒸馏水洗净后,不能用待配液润洗,否则导致待配液浓度偏高,符合题意,B正确;
C.配置溶液时,如果试样是固体,把称好的试样在小烧杯中溶解,待恢复至室温后,转移到容量瓶中,并缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线,符合题意,C正确;
D.配制溶液时,如果试样是液体,用量筒量取试样后在小烧杯中稀释,再倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线,符合题意,D正确;
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,与题意不符,E错误;
F.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致配液的体积偏大,浓度偏低,符合题意,F正确;
答案为BCDF。


科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论不一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A、 |
| 通过观察液面差判断该装置的气密性 |
B、 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C、 | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗涤的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D、 | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 不能检验制得气体是否为乙烯 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是研究物质所含微粒集体的多少,单位为mol
B.物质的量把微观粒子数目与宏观物质的质量联系起来
C.1molNaCl晶体中含有NA个NaCl分子
D.12gC-12中所含的原子数为阿伏加德罗常数,NA近似为6.02×1023mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应mA(s)+nB(g)![]() eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
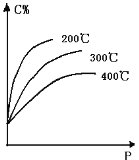
A. 化学方程式中n<e+f
B. 达到平衡后,加入催化剂,则C%增大
C. 达到平衡后,若升温,平衡逆向移动
D. 达到平衡后,增加A的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是

A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时有甲、乙、丙三种溶液,甲为0.1mol·L-1NaOH溶液,乙为0.1mol·L-1HCl溶液,丙为0.1 mol·L-1CH3COOH溶液,请回答下列问题:
(1)甲溶液的pH=___________________。
(2)乙溶液中由水电离出的c(H+)=___________________mol·L-1。
(3)写出丙的电离方程式_________________________________________________________,其电离平衡常数表达式Ka=___________________。
(4)向丙中加入乙,会_____________(“抑制”或“促进”)丙的电离,c(H+)_____________(填“增大”、“减小”或“不变”), 丙的电离平衡常数Ka_____________(填“增大”、“减小”或“不变”)。
(5)各取25 mL的乙、丙两溶液,分别用甲中和至pH=7,则消耗甲的体积大小关系为V(乙) ____________V (丙)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18gmL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度为_________ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中c(HCl)=_____mol·L-1。
(3)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com