
ΓΨΧβΡΩΓΩΕΧ÷ήΤΎ÷ςΉε‘ΣΥΊ XΓΔYΓΔZΓΔWΒΡ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§ΥΡ÷÷‘ΣΥΊ–Έ≥…ΒΡΒΞ÷ “ά¥ΈΈΣmΓΔnΓΔpΓΔqΘΜrΓΔtΓΔu «’β–©‘ΣΥΊΉι≥…ΒΡΕΰ‘ΣΜ·ΚœΈοΘ§Τδ÷–uΈΣΤœΧ―ΨΤ÷–ΒΡ“÷Ψζ≥…Ζ÷ΘΜ25 ΓφΘ§0.01 mol/LΒΡv»ή“Κ÷–ΘΚ  = 1.0ΓΝ10-10ΓΘ…œ ωΈο÷ ΒΡΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
= 1.0ΓΝ10-10ΓΘ…œ ωΈο÷ ΒΡΉΣΜ·ΙΊœΒ»γΆΦΥυ ΨΘ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «

A. ΦρΒΞάκΉ”ΑκΨΕΘΚW>Y>Z>X
B. WΘ§YΖ÷³e”κX‘ΣΥΊ–Έ≥…ΒΡΦρΒΞΜ·ΚœΈοΒΡΖ–ΒψΘΚ Y> W
C. Z2YΚΆZXΕΦ÷Μ¥φ‘ΎάκΉ”Φϋ
D. vΡή“÷÷ΤΥ°ΒΡΒγάκΘ§uΡή¥ΌΫχΥ°ΒΡΒγάκ
ΓΨ¥πΑΗΓΩD
ΓΨΫβΈωΓΩ25 ΓφΘ§0.01 mol/LΒΡv»ή“Κ÷–ΘΚ 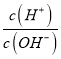 = 1.0ΓΝ10-10Θ§ΥΒΟςv «“Μ‘Σ«ΩΦνΘ§v «NaOHΘΜuΈΣΤœΧ―ΨΤ÷–ΒΡ“÷Ψζ≥…Ζ÷Θ§u «SO2ΘΜXΓΔYΓΔZΓΔWΒΡ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§Υυ“‘XΓΔYΓΔZΓΔWΖ÷±π «HΓΔOΓΔNaΓΔSΥΡ÷÷‘ΣΥΊΘΜΦρΒΞάκΉ”ΑκΨΕΘΚS2->O2->Na+>H+Θ§Ι A’ΐ»ΖΘΜH2OΒΡΖ–Βψ¥σ”ΎH2SΘ§Ι B’ΐ»ΖΘΜNa2OΓΔNaH÷Μ¥φ‘ΎάκΉ”ΦϋΘ§Ι C’ΐ»ΖΘΜΕΰ―θΜ·ΝρΒΡΥ°»ή“Κ «―«ΝρΥαΘ§Ρή“÷÷ΤΥ°ΒΡΒγάκΘ§Ι D¥μΈσΓΘ
= 1.0ΓΝ10-10Θ§ΥΒΟςv «“Μ‘Σ«ΩΦνΘ§v «NaOHΘΜuΈΣΤœΧ―ΨΤ÷–ΒΡ“÷Ψζ≥…Ζ÷Θ§u «SO2ΘΜXΓΔYΓΔZΓΔWΒΡ‘≠Ή”–ρ ΐ“ά¥Έ‘ω¥σΘ§Υυ“‘XΓΔYΓΔZΓΔWΖ÷±π «HΓΔOΓΔNaΓΔSΥΡ÷÷‘ΣΥΊΘΜΦρΒΞάκΉ”ΑκΨΕΘΚS2->O2->Na+>H+Θ§Ι A’ΐ»ΖΘΜH2OΒΡΖ–Βψ¥σ”ΎH2SΘ§Ι B’ΐ»ΖΘΜNa2OΓΔNaH÷Μ¥φ‘ΎάκΉ”ΦϋΘ§Ι C’ΐ»ΖΘΜΕΰ―θΜ·ΝρΒΡΥ°»ή“Κ «―«ΝρΥαΘ§Ρή“÷÷ΤΥ°ΒΡΒγάκΘ§Ι D¥μΈσΓΘ


 άχ‘≈ ι“Β νΦΌœΈΫ”Ρΰ≤®≥ωΑφ…γœΒΝ–¥πΑΗ
άχ‘≈ ι“Β νΦΌœΈΫ”Ρΰ≤®≥ωΑφ…γœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ÷–ΜΣ”ο―‘≤©¥σΨΪ…νΘ§œ¬Ν–¥ ”ο÷–Θ§ΤδΚ§“β «Έοάμ±δΜ·ΒΡ «
A.ά·Ψφ≥…Μ“B.‘χ«ύΒΟΧζC.ΑΌΝΕ≥…Η÷D.¥σάΥΧ‘…≥
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ±Ϋ «Ε‘ΟΚΒΡΉέΚœάϊ”ΟΒΟΒΫΒΡ≤ζΈο÷°“ΜΘ§ΤδΫαΙΙΦρ ΫΈΣ ΓΘ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΓΘ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)±Ϋ”κΦΉ±ΫΒΡœύΜΞΙΊœΒΈΣ_________ΓΘ
AΘ°Ά§Ζ÷“λΙΙΧε | BΘ°Ά§ΈΜΥΊ |
CΘ°Ά§ΥΊ“λ–ΈΧε | DΘ°Ά§œΒΈο |
(2)ΦΉ±Ϋ»Φ…’ ±ΒΡœ÷œσΈΣ________________________Θ§1 molΦΉ±ΫΆξ»Ϊ»Φ…’œϊΚΡ―θΤχΒΡΈο÷ ΒΡΝΩΈΣ________ΓΘ
(3)ΦΉ±Ϋ±ΫΜΖ…œΒΡ“Μ¬»¥ζΈο”–________÷÷ΓΘ
(4)“―÷ΣΨΏ”– ΫαΙΙΒΡΈο÷ Ω…±ΜΥα–‘ΗΏΟΧΥαΦΊ―θΜ·ΓΘ«χΖ÷±ΫΚΆΦΉ±ΫΒΡΖΫΖ® «________ΓΘ
ΫαΙΙΒΡΈο÷ Ω…±ΜΥα–‘ΗΏΟΧΥαΦΊ―θΜ·ΓΘ«χΖ÷±ΫΚΆΦΉ±ΫΒΡΖΫΖ® «________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β≤ζ…ζΒΡΖœΤχCOxΓΔNOxΓΔSOxΕ‘ΜΖΨ≥”–ΚΠΘ§»τΡήΚœάμΒΡάϊ”ΟΈϋ ’Θ§Ω…“‘Φθ…ΌΈέ»ΨΘ§±δΖœΈΣ±ΠΓΘ
(1)“―÷ΣΦΉΆιΒΡ»Φ…’»»ΈΣ890 kJ/molΘΜ1 molΥ°’τΤχ±δ≥…“ΚΧ§Υ°Ζ≈»»44 kJΘΜN2”κO2Ζ¥”Π…ζ≥…NOΒΡΙΐ≥Χ»γœ¬ΘΚ

‘ρCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΓςH=_______.
(2)Τϊ≥ΒΈ≤Τχ÷–Κ§”–COΚΆNOΘ§Ρ≥―–ΨΩ–ΓΉιάϊ”ΟΖ¥”ΠΘΚ2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g) Βœ÷ΤχΧεΒΡΈόΚΠΜ·≈≈Ζ≈ΓΘT1Γφ ±Θ§‘ΎΚψ»ίΒΡΟή±’»ίΤς÷–Ά®»κ“ΜΕ®ΝΩΒΡCOΚΆNOΘ§ΡήΉ‘ΖΔΫχ––…œ ωΖ¥”ΠΘ§≤βΒΟ≤ΜΆ§ ±ΦδΒΡNOΚΆCOΒΡ≈®Ε»»γœ¬±μΘΚ
N2 (g)+2CO2 (g) Βœ÷ΤχΧεΒΡΈόΚΠΜ·≈≈Ζ≈ΓΘT1Γφ ±Θ§‘ΎΚψ»ίΒΡΟή±’»ίΤς÷–Ά®»κ“ΜΕ®ΝΩΒΡCOΚΆNOΘ§ΡήΉ‘ΖΔΫχ––…œ ωΖ¥”ΠΘ§≤βΒΟ≤ΜΆ§ ±ΦδΒΡNOΚΆCOΒΡ≈®Ε»»γœ¬±μΘΚ

ΔΌ0ΓΪ2 sΡΎ”ΟN2±μ ΨΒΡΜ·―ßΖ¥”ΠΥΌ¬ ΈΣ____Θ§ΗΟΈ¬Ε»œ¬Θ§Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐK1_____ΓΘ
ΔΎ»τΗΟΖ¥”Π‘ΎΨχ»»Κψ»ίΧθΦΰœ¬Ϋχ––Θ§‘ρΖ¥”Π¥οΒΫΤΫΚβΚσΧεœΒΒΡΈ¬Ε»ΈΣT2ΓφΘ§¥Υ ±ΒΡΜ·―ßΤΫΚβ≥Θ ΐΈΣK2Θ§‘ρK1____K2Θ®ΧνΓΑ>Γ±ΓΔΓΑ<Γ±ΜρΓΑ=Γ±Θ©Θ§‘≠“ρ «________
(3)œρΦΉΓΔ““ΝΫΗω»ίΜΐΨυΈΣ1 LΒΡΚψΈ¬Κψ»ίΒΡΟή±’»ίΤς÷–Θ§Ζ÷±π≥δ»κ“ΜΕ®ΝΩΒΡSO2ΚΆO2(Τδ÷–Θ§ΦΉ≥δ»κ2 mol SO2ΓΔ1 mol O2Θ§““≥δ»κ1 mol SO2ΓΔ0.5 mol O2)Θ§ΖΔ…ζΖ¥”ΠΘΚ2SO2(g)+O2 (g) ![]() 2SO3 (g) ΓςH= -197. 74 kJ/mol Θ§“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΘ§≤βΒΟΝΫ»ίΤς÷–c(SO2)(mol/L)Υφ ±Φδt(min)ΒΡ±δΜ·ΙΊœΒ»γ”“ΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «______
2SO3 (g) ΓςH= -197. 74 kJ/mol Θ§“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΘ§≤βΒΟΝΫ»ίΤς÷–c(SO2)(mol/L)Υφ ±Φδt(min)ΒΡ±δΜ·ΙΊœΒ»γ”“ΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «______

AΘ°Ζ≈≥ωΒΡ»»ΝΩQ:Q(ΦΉ)>2QΘ®““Θ©
BΘ°ΧεœΒΉή―Ι«ΩpΘΚpΘ®ΦΉΘ©>2p(““)
CΘ°ΦΉ»ίΤς¥οΒΫΜ·―ßΤΫΚβ ±Θ§ΤδΜ·―ßΤΫΚβ≥Θ ΐΈΣ4
DΘ°±Θ≥÷ΤδΥϊΧθΦΰ≤Μ±δΘ§»τΤπ Φ ±œρ““÷–≥δ»κ0.4 mol SO2ΓΔ0.2mol O2ΓΔ0.4 molSO3Θ§‘ρ¥Υ ±v(’ΐ>v(Ρφ)
(4)‘Ύ«ΩΥα–‘ΒΡΒγΫβ÷ Υ°»ή“Κ÷–Θ§Εη–‘≤ΡΝœΉωΒγΦΪΘ§ΒγΫβCO2Ω…ΒΟΒΫΕύ÷÷»ΦΝœΘ§Τδ‘≠άμ»γ”“ΆΦΥυ ΨΓΘ

ΔΌΗΟΙΛ“’÷–ΡήΝΩΉΣΜ·ΖΫ Ϋ÷ς“Σ”–____ΓΘ
ΔΎΒγΫβ ±Θ§…ζ≥…““œ©ΒΡΒγΦΪΖ¥”Π Ϋ «____ΓΘ
(5)CO2‘ΎΉ‘»ΜΫγ―≠ΜΖ ±Ω…”κCaC03Ζ¥”ΠΘ§Ca-CO3 «“Μ÷÷Ρ―»ήΈο÷ Θ§ΤδKsp=2.8ΓΝ10-9ΓΘCaCl2»ή“Κ”κNa2 CO3»ή“ΚΜλΚœΩ…–Έ≥…CaCO3≥ΝΒμΘ§œ÷ΫΪΒ»ΧεΜΐΒΡCaCl2»ή“Κ”κNa2 CO3»ή“ΚΜλΚœΘ§»τNa2 C03»ή“ΚΒΡ≈®Ε»ΈΣ2ΓΝ10-4 molΘ·LΘ§‘ρ…ζ≥…≥ΝΒμΥυ–ηCaCl2»ή“ΚΒΡΉν–Γ≈®Ε»ΈΣ_________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΝρΥα―«Χζ «άϊ”Ον―ΧζΩσΘ®÷ς“Σ≥…Ζ÷FeTiO3Θ©÷ΤΫπ τν―ΒΡΗ±≤ζΤΖΘ§ΦέΗώΒΆΓΘ“‘ΝρΥα―«ΧζΈΣ‘≠Νœ÷Τ±ΗΗΏ–ßΨΜΥ°ΦΝΗΏΧζΥαΦΊ(K2FeO4)Ω…¥σ¥σΫΒΒΆ≥…±ΨΓΘΤδ…ζ≤ζΙΛ“’»γœ¬ΘΚ

“―÷ΣΘΚNaNO2 «‘ΎΩ’Τχ÷–ΫΪFe2+―θΜ·ΈΣΧζΜΤ(FeOOH)ΒΡ¥ΏΜ·ΦΝΘΜΧζΜΤΈΔ»ή”ΎΥαΓΘ
«κΈ ¥πœ¬Ν–Έ ΧβΘΚ
(1)–¥≥ωΖ¥”ΠΔΌ…ζ≥…ΧζΜΤ(FeOOH)ΒΡάκΉ”ΖΫ≥Χ ΫΘΚ__________________________________Θ§
‘ΎΆ®»κO2ΓΑ―θΜ·Γ±FeSO4ΒΡΙΐ≥Χ÷–Θ§»ή“ΚΒΡpH________Θ®ΧνΓΑ‘ω¥σΓ±ΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±Θ©
(2)ΓΑΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΓ±÷Τ±ΗΧζΜΤ ±Θ§Φλ―ιΧζΜΤ±μΟφ“―œ¥Β”Η…ΨΜΒΡ≤ΌΉς «_____ΓΘ
(3)–¥≥ωΖ¥”ΠΔέΒΡΜ·―ßΖΫ≥Χ ΫΘΚ ____ΓΘ
(4)‘Ύ»ή“ΚI÷–Φ”KOHΙΧΧεΒΡΡΩΒΡ «_____ΓΘ
(5) K2FeO4Ω…ΉςΈΣ–¬–ΆΕύΙΠΡήΥ°¥ΠάμΦΝΒΡ‘≠“ρ «____ΓΘ
(6)ΗΟΙΛ“’ΟΩœϊΚΡ±ξΉΦΉ¥Ωωœ¬ll2LCl2άμ¬έ…œΒΟΒΫ____g K2FeO4ΓΘ
(7)ν―ΧζΩσΦ”»κ≈®ΝρΥα≥ΐ…ζ≥…TiOSO4ΆβΘ§ΜΙ…ζ≥…Υ°ΚΆΝμΆβ“Μ÷÷ΝρΥα―ΈΘ§«“Ζ¥”Π«ΑΚσΧζΒΡΜ·ΚœΦέ≤Μ±δΘ§Μ·―ßΖΫ≥Χ ΫΈΣ____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“‘““»≤ΈΣ÷ς“Σ‘≠ΝœΩ…“‘Κœ≥…Ψέ¬»““œ©ΓΔΨέ±ϊœ©κφΚΆ¬»ΕΓœπΫΚΓΘ«κ–¥≥ωΔΌΓΪΔΏΗς≤ΫΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΓΘ

ΔΌ_________________________________
ΔΎ____________________________________
Δέ________________________________________
Δή___________________________________________________
Δί__________________________________________________
Δό__________________________________________
ΔΏ_______________________________________________________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§œ¬Ν–ΙΊΊΓΒγΫβ÷ ΒΡΥΒΖ®÷–’ΐ»ΖΒΡ «
A. ÷–ΚΆΒ»ΧεΜΐΓΔΒ»≈®Ε»ΒΡΑ±Υ°ΚΆ«β―θΜ·ΡΤ»ή“Κ÷ΝpHΒ»”Ύ7Θ§«Α’ΏœϊΚΡΒΡ―ΈΥαΕύ
B. œρNaHS »ή“Κ÷–Φ”»κ ΝΩ KOH ΚσΘΚc(Na+)=c(H2S)+c(HS-)+c(S2-)
C. ΫΪamolΓΛL-1ΒΡ¥ΉΥα”κ0.01 molΓΛL-1ΒΡ«β―θΜ·ΡΤ»ή“ΚΒ»ΧεΜΐΜλΚœΘ§»ή“Κ÷–ΘΚc(Na+)=c(CH3COO-)Θ§¥ΉΥαΒΡΒγάκ≥Θ ΐKa=![]() (”ΟΚ§aΒΡ¥ζ ΐ Ϋ±μ ΨΘ©
(”ΟΚ§aΒΡ¥ζ ΐ Ϋ±μ ΨΘ©
D. œρNH4Cl»ή“Κ÷–Φ”»κ…ΌΝΩΒ»≈®Ε»ΒΡœΓ―ΈΥαΘ§‘ρ ΒΡ÷ΒΦθ–Γ
ΒΡ÷ΒΦθ–Γ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈ“ΙζΩΤ―ßΦ“ΆάΏœΏœ“ρΖΔœ÷ΩΙ≈±Φ≤–¬“©«ύίοΥΊ(C15H22O5)Εχ»ΌΜώ2015Ρξ≈Β±¥Εϊ…ζάμ―ßΜρ“Ϋ―ßΫ±ΓΘ«ύίοΥΊ τ”Ύ
A. ΈόΜζΈο B. ―θΜ·Έο C. «βΜ·Έο D. ”–ΜζΈο
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ3Ηω2 LΒΡΟή±’»ίΤς÷–Θ§‘ΎœύΆ§ΒΡΈ¬Ε»œ¬ΓΔ Ι”ΟœύΆ§ΒΡ¥ΏΜ·ΦΝΖ÷±πΫχ––Ζ¥”ΠΘΚ
3H2(g)+N2(g) ![]() 2NH3(g)ΓΘΑ¥≤ΜΆ§ΖΫ ΫΆΕ»κΖ¥”ΠΈοΘ§±Θ≥÷ΚψΈ¬ΓΔΚψ»ίΘ§≤βΒΟΖ¥”Π¥οΒΫΤΫΚβ ±”–ΙΊ ΐΨί»γœ¬±μΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «
2NH3(g)ΓΘΑ¥≤ΜΆ§ΖΫ ΫΆΕ»κΖ¥”ΠΈοΘ§±Θ≥÷ΚψΈ¬ΓΔΚψ»ίΘ§≤βΒΟΖ¥”Π¥οΒΫΤΫΚβ ±”–ΙΊ ΐΨί»γœ¬±μΓΘœ¬Ν––π ω’ΐ»ΖΒΡ «
»ίΤς±ύΚ≈ | Τπ ΦΖ¥”ΠΈο | ¥οΒΫΤΫΚβΒΡ ±Φδ(min) | ΤΫΚβ ±N2ΒΡ≈®Ε»(mol/L) | ΤΫΚβ ±ΤχΧεΟήΕ» |
ΦΉ | 3molH2ΓΔ2molN2 | t1 | c1 | Π―1 |
““ | 6molH2ΓΔ4molN2 | 5 | 1.5 | Π―2 |
±ϊ | 2molNH3 | 8 | c3 | Π―3 |
A. 2Π―1=Π―2>Π―3
B. »ίΤς““÷–Ζ¥”Π¥”ΩΣ ΦΒΫ¥οΤΫΚβΒΡΖ¥”ΠΥΌ¬ ΈΣvΘ®H2Θ©=0.05mol/(LΓΛmin)
C. c1ΘΦc3
D. 2c1ΘΦ1.5
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com