
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:

则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:

①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______

A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。

①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
【答案】 -612 kJ·mol-1 1.875×10-4mol/(L·s) 5000 > 2CO+2NO![]() N2+2CO2 的△S<0,只有当△H<0,时△G=△H-T△S才能小于0,反应才能在一定条件下自发进行,所以该反应为放热反应。若该反应在绝热恒容条件下进行,由于初始时只有反应物,反应一定正向进行,达到平衡后反应体系温度升高,所以T1<T2,对于放热反应,温度升高,平衡初始减小,所以K1>K2 AC 太阳能转化为电能;电能转化为化学能
N2+2CO2 的△S<0,只有当△H<0,时△G=△H-T△S才能小于0,反应才能在一定条件下自发进行,所以该反应为放热反应。若该反应在绝热恒容条件下进行,由于初始时只有反应物,反应一定正向进行,达到平衡后反应体系温度升高,所以T1<T2,对于放热反应,温度升高,平衡初始减小,所以K1>K2 AC 太阳能转化为电能;电能转化为化学能 ![]() 5.6×10—5mo1/L
5.6×10—5mo1/L
【解析】(1)根据图示,旧键断裂吸收能量为:945+498=1443KJ/mol,放出能量为:2×630=1260KJ/mol,则热化学方程式为2NO(g)=O2(g)+N2(g)△H=-1260+1443=183KJ/mol①;甲烷燃烧热为890kJ/mol,可写出热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l),△H=-890kJ/mol②;H2O(g)=H2O(l),△H=-44kJ/mol③;由盖斯定律可知②+①×2-③×2,可得CH4 (g) +4NO(g)=2N2 (g) +CO2 (g) +2H2 O(g) △H=-890kJ/mol+183/mol×2-(44kJ/mol)×2=-612kJmol-1,故答案为:-612kJmol-1;
(2) ①前2s内的平均反应速率v(N2)= ![]() v(N0)=
v(N0)= ![]() ×
×![]() =1.875×10-4mol/(L·s),由表格中的数据可知到4s时达到化学平衡,则
=1.875×10-4mol/(L·s),由表格中的数据可知到4s时达到化学平衡,则
2NO + 2CO![]() 2CO2 + N2,
2CO2 + N2,
开始(mol/L) 1.00×10-3 3.60×10-3 0 0
转化(mol/L) 9×10-4 9×10-4 9×10-4 4.50×10-4
平衡(mol/L) 1.00×10-4 2.70×10-3 9×10-4 4.50×10-4
则 K=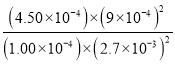 =5000,故答案为:1.875×10-4mol/(L·s);5000
=5000,故答案为:1.875×10-4mol/(L·s);5000
②2CO+2NO![]() N2+2CO2 的△S<0,只有当△H<0,时△G=△H-T△S才能小于0,反应才能在一定条件下自发进行,所以该反应为放热反应。若该反应在绝热恒容条件下进行,由于初始时只有反应物,反应一定正向进行,达到平衡后反应体系温度升高,所以T1<T2,对于放热反应,温度升高,平衡初始减小,所以K1>K2 ,故答案为:> ;2CO+2NO
N2+2CO2 的△S<0,只有当△H<0,时△G=△H-T△S才能小于0,反应才能在一定条件下自发进行,所以该反应为放热反应。若该反应在绝热恒容条件下进行,由于初始时只有反应物,反应一定正向进行,达到平衡后反应体系温度升高,所以T1<T2,对于放热反应,温度升高,平衡初始减小,所以K1>K2 ,故答案为:> ;2CO+2NO![]() N2+2CO2 的△S<0,只有当△H<0,时△G=△H-T△S才能小于0,反应才能在一定条件下自发进行,所以该反应为放热反应。若该反应在绝热恒容条件下进行,由于初始时只有反应物,反应一定正向进行,达到平衡后反应体系温度升高,所以T1<T2,对于放热反应,温度升高,平衡初始减小,所以K1>K2;
N2+2CO2 的△S<0,只有当△H<0,时△G=△H-T△S才能小于0,反应才能在一定条件下自发进行,所以该反应为放热反应。若该反应在绝热恒容条件下进行,由于初始时只有反应物,反应一定正向进行,达到平衡后反应体系温度升高,所以T1<T2,对于放热反应,温度升高,平衡初始减小,所以K1>K2;
(3)A.该反应反应前气体体积大于反应后体积,即充入反应物物质的量越大则压强越大,进行程度较大,放出热量Q(甲)>2Q(乙),故A正确;B.该反应反应前气体体积大于反应后体积,即充入反应物物质的量越大则压强越大,进行程度较大,则压强p(甲)<2p(乙),故B错误;C.乙容器达到化学平衡状态时,c(SO2)=0.5mol/L,c(O2)=0.5mol/L-0.5mol/L×![]() =0.25mol/L,c(SO3)=0.5mol/L,K=
=0.25mol/L,c(SO3)=0.5mol/L,K=![]() =4,故C正确;D.浓度商为:
=4,故C正确;D.浓度商为: ![]() =5,浓度商大于化学平衡常数,化学平衡向逆反应方向移动,即v(正)<v(逆),故D错误;故选AC;
=5,浓度商大于化学平衡常数,化学平衡向逆反应方向移动,即v(正)<v(逆),故D错误;故选AC;
(4)①太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,可知能量转化形式有光能转化为电能,电能转化为化学能,部分电能转化为热能,故答案为:太阳能转化为电能,电能转化为化学能;
②电解时,二氧化碳在b极上生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故答案为:正;2CO2+12H++12e-=C2H4+4H2O;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=![]() ×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=![]() mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,故答案为:5.6×10-5 mo1/L。
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,故答案为:5.6×10-5 mo1/L。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)目前工业上有一种方法是用CO,和H2在230℃,催化剂条件下转化生成甲醇蒸汽和水蒸气。
图一表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图。写出该反应的热化学方程式_____________。
(2) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO4溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图二所示。

请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(3)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图三所示:
① 请写出N2的电子式________。
② 曲线c对应NH3与NO的物质的量之比是______。
③ 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(4)间接电化学法可除NO。其原理如图四所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商品“纯净水”、“太空水”、“蒸馏水”等作为日常饮料水,因缺少某些成分而不利于少年儿童身体健康,你认为在制备上述商品饮用水时至少还需要添加微量的化学物质( )
A.钙和镁的碳酸氢盐B.含碘酸盐的食盐
C.漂白粉等消毒剂D.小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、B同主族, B、C、D.E同周期,B的核外电子数为C的1/2,D的最外层电子数为C、E之和的一半。 下列说法正确的是
A. A、B能形成离子化合物,且A离子半径小于B离子半径
B. A、D能形成离子化合物DA5,与水反应可产生两种气体
C. C、D的简单氢化物中只有D溶于水,其水溶液呈酸性
D. E形成的两种氢化物中所有化学键种类完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2,则关于该反应体系说法错误的是
A.该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O
B.该反应中的氧化剂是H2O2,还原产物是O2
C.氧化性:H2CrO4>O2
D.如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见的病毒与细菌。下面有关该物质的说法正确的是

A. 该物质的分子式是C8H10ClO
B. 1mol该物质最多可以与2mol NaOH反应
C. 1mol该物质可以与2mol液溴发生取代反应
D. 该物质可以发生加成、取代、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中:  = 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是
= 1.0×10-10。上述物质的转化关系如图所示,下列说法不正确的是

A. 简单离子半径:W>Y>Z>X
B. W,Y分別与X元素形成的简单化合物的沸点: Y> W
C. Z2Y和ZX都只存在离子键
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫的说法中,不正确的是( )
A.使某些有机色质褪色 B.无色,有刺激性气味,无毒
C.既有氧化性,又有还原性 D.既可溶于水,又可与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g) + B(g)![]() 2D(g)△H=Q kJ·mol–1。相关条件和数据见下表:
2D(g)△H=Q kJ·mol–1。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/ mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K 2 | K 3 |
下列说法正确的是
A. K 3>K 2=K 1
B. 实验Ⅱ可能使用了催化剂
C. 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的![]() 倍
倍
D. 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com