
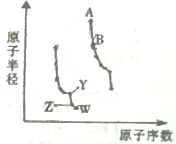
 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化. .
. 分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,W为F元素,Z为O元素,Y为
N元素,A为Cl元素,B为S元素,结合元素周期律与物质的性质等解答.
(1)B为S元素,主族元素周期数=电子层数,族序数等于最外层电子数;
(2)同周期从左向右,非金属性逐渐增强,非金属性越强,氢化物越稳定;
(3)生活中最常用的过渡金属单质为铁,在O2中点燃生成四氧化三铁,为确定其固体生成物中金属的化合价,先用非强氧化性的酸溶解,后用KSCN溶液检验铁离子的存在;
(4)①淡黄色固体可能为S或过氧化钠,甲+H2O→乙+丙,丙为气体,则乙为过氧化钠;
②Y为N元素,若丙为Y的氧化物,则Y为NO,甲为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,硝酸具有氧化性,氧化二氧化硫为硫酸根离子,自身被还原成一氧化氮;
③若甲为有机物,则甲可以为酯,酯可以发生水解反应;
(5)正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量;
(6)NaBH4为离子化合物,含离子键、共价键,据此写出其电子式;
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,W为F元素,Z为O元素,Y为N元素,A为Cl元素,B为S元素.
(1)B为S元素,原子核外电子数为11,有3个电子层,最外层电子数为1,处于周期表中第三周期ⅥA族,
故答案为:第三周期ⅥA族;
(2)W为F元素,Z为O元素,为同周期元素,F的非金属性强于O,所以氢化物稳定性,HF>H2O,
故答案为:HF;
(3)生活中最常用的过渡金属单质为铁,在O2中点燃生成四氧化三铁,为确定其固体生成物中金属的化合价,先用非强氧化性的硫酸溶解,不能用硝酸,因硝酸具有强氧化性,能氧化亚铁离子,铁离子和KSCN络合显示血红色,所以用KSCN溶液检验铁离子的存在,亚铁离子能还原高锰酸根离子,能使高锰酸钾溶液褪色,所以可以用高锰酸钾溶液检验亚铁离子的存在,
故答案为:ACD;
(4)①淡黄色固体可能为S或过氧化钠,甲+H2O→乙+丙,硫和水不反应,2Na2O2+2H2O=4NaOH+O2↑,符合丙为气体,则乙为过氧化钠,
故答案为:Na2O2;
②Y为N元素,若丙为Y的氧化物,则Y为NO,甲为二氧化氮,二氧化氮和水反应3NO2+H2O=2HNO3+NO,生成的硝酸具有氧化性,氧化二氧化硫为硫酸根离子,自身被还原成一氧化氮,离子反应为:2H2O+3SO2+2NO3-=2NO+4H++3SO42-,
故答案为:2H2O+3SO2+2NO3-=2NO+4H++3SO42-;
③若甲为有机物,则甲可以为酯,酯可以发生水解反应,例如乙酸乙酯的水解,反应的方程式为CH3COOC2H5+H2O$→_{△}^{酸}$nCH3COOH+CH3CH2OH,
故答案为:CH3COOC2H5+H2O$→_{△}^{酸}$nCH3COOH+CH3CH2OH;
(5)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299;
(6)NaBH4为离子化合物,含离子键、共价键,其电子式为 ,
,
故答案为: .
.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
 表示.下列说法不正确的是( )
表示.下列说法不正确的是( )| A. | X属于烃 | |
| B. | X能使酸性高锰酸钾溶液褪色 | |
| C. | X与 互为同分异构体 互为同分异构体 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 过氧化钠是强氧化剂,能氧化二氧化碳,因此过氧化钠可作呼吸面具中的供氧剂 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 对容量瓶内液体定容时,俯视读数导致物质的量浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 盐酸与铝片反应后,盐酸还有剩余 | |
| B. | 图中B点之前发生的离子反应为Al3++3OH-═Al(OH)3↓ | |
| C. | A→B段消耗的NaOH体积与B→C段消耗的Na 0 H体积比≥3:1 | |
| D. | 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加100mL水将溶液稀释 | |
| B. | 向溶液中加入0.2molNaOH固体,并使之完全溶解 | |
| C. | 将溶剂蒸发掉一半 | |
| D. | 将原溶液浓缩至50mL(无NaOH析出) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com