
 表示.下列说法不正确的是( )
表示.下列说法不正确的是( )| A. | X属于烃 | |
| B. | X能使酸性高锰酸钾溶液褪色 | |
| C. | X与 互为同分异构体 互为同分异构体 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
分析 A.烃是指仅含碳氢两种元素化合物;
B.含有不饱和键碳碳双键,易被酸性高锰酸钾氧化;
C.同分异构体是指分子式相同,但结构不同的化合物;
D.分子中有几种化学环境不同的H就有几种一氯代物.
解答 解:A.X的化学式为C8H8,仅含C、H两种元素,属于烯烃,故A正确;
B.X含有不饱和键碳碳双键,被酸性高锰酸钾溶液氧化,酸性高锰酸钾褪色,故B正确;
C. 分子式为C8H8,其结构与X不同,互为同分异构体,故C正确;
分子式为C8H8,其结构与X不同,互为同分异构体,故C正确;
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的分子中含2个CH,6个CH2,共2种位置的H,所以该物质的一氯代物有2种,故D错误;
故选D.
点评 本题考查有机物的结构,侧重有机物空间结构的考查,注意根据结构来解答,注意等效氢的应用,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取8gNaOH固体,放入100mL量筒,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL | |
| B. | 称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8gNaOH固体放入300mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 | |
| D. | 用50mL量筒量取50mL4mol/LNaOH溶液,倒入100mL烧杯中,再用同一量筒取50mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1 | B. | △H2 | C. | △H3 | D. | △H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2溶于水 | |
| B. | NH3溶于水 | |
| C. | 可充电电池的反应如H2O+Zn+Ag2O$?_{充电}^{放电}$Zn(OH)2+Ag | |
| D. | 电解水生产H2和O2,点燃H2和O2的混合物生产水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
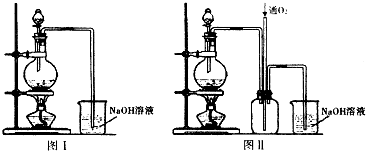
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | |
| B. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| C. | 离子化合物中只含离子键 | |
| D. | 离子化合物中一定含有金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
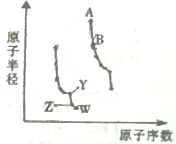 如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化.
如图是元素周期表中几种短周期主族元素原子半径随原子序数的变化. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com