
| ||
| ||


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、皮肤上沾上浓硫酸应立即用氢氧化钠溶液中和 |
| B、酒精灯中酒精不慎洒出在桌上燃烧,应立即用湿布扑盖 |
| C、氢氧化钠溶液溅到眼睛中,立即闭上眼睛,轻轻揉搓 |
| D、实验中出现轻微气体中毒,受伤人员应立即伏到实验桌上好好休息 |
查看答案和解析>>
科目:高中化学 来源: 题型:
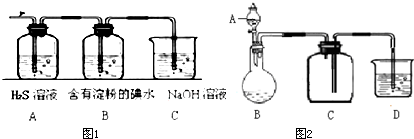
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
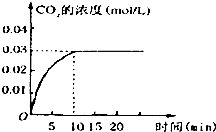 在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图:
在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图:查看答案和解析>>
科目:高中化学 来源: 题型:
 下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:
下面是用10mol/L的浓H2SO4配制成浓度为0.1mol/L的 500mL稀H2SO4的操作,请按要求填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com