

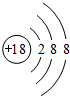
 ,故答案为:
,故答案为: ;
;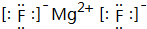 ,故答案为:
,故答案为: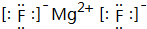 ;
; +HNO3
+HNO3| 浓硫酸 |
| △ |
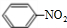 +H2O,
+H2O, +HNO3
+HNO3| 浓硫酸 |
| △ |
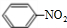 +H2O.
+H2O.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
| A、S(s)+O2(g)=SO2 (g);△H1 S(g)+O2(g)=SO2 (g);△H2 | ||||
| B、2H2(g)+O2 (g)=2H2O(g);△H1 2H2 (g)+O2 (g)=2H2O(l);△H2 | ||||
| C、CO(g)+1/2 O2(g)=CO2(g);△H1 2CO(g)+O2(g)=2CO2(g);△H2 | ||||
D、H2 (g)+Cl2(g)=2HCl(g);△H1
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强减小 |
| D、BaO2量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焰色反应为化学变化 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、焰色反应均应透过蓝色钴玻璃观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ?mol-1 | 243kJ?mol-1 | 431kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 1 |
| 2 |
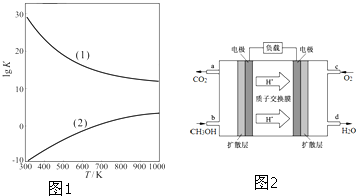
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com