

【题目】下列说法不正确的是
A. 二氧化硫和氯气都能使品红溶液褪色
B. 漂白粉暴露在空气中久置会变质
C. 在加热条件下,镁能在二氧化碳气体中燃烧
D. 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子
科目:高中化学 来源: 题型:
【题目】如图所示:挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球影响,以及外界和广口瓶间热量的传递影响)。则所用试剂不可能是
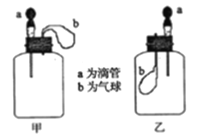
A. 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体)
B. 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气
C. 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液
D. 甲:稀盐酸和大理石粉末(固体);乙:H2O和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如下图所示)。
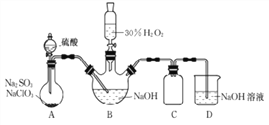
已知:
(I)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3·3H2O,高于38℃时析出晶体是NaClO2;
(Ⅱ)30 % H2O2超过40℃时会完全分解;
(Ⅲ)高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置A发生的反应中,还原剂是________。
(2)①装置B中反应生成NaClO2的化学方程式为____________。
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有________、_______。
(3)请补充从装置B反应后的溶液中获得NaClO2晶体的操作步骤。
①在55 ℃时蒸发结晶;②_______;③ ________;④________;得到成品。
(4)装置C的作用是______________。
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性的实验方案是________。(可供选用的试剂:稀H2SO4、FeCl2溶液、KSCN溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的新一代动车组在京沪高铁上跑出过486.1公里的世界列车最高时速,这得益于全路铺设的优质无缝平滑的超长钢轨。下列有关说法不正确的是
A. 制造钢轨的材料是钢,钢是用量最大的合金
B. 钢的熔点比铁的熔点高,而铁的用途更广泛
C. 我国在商代就开始使用铜合金
D. 铝合金的强度、硬度比组成合金各成分金属的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中,不正确的是
A.氯化钠和氯化铯晶体中,阳离子的配位数均为6
B.金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由氯化铵制取氯气的工艺原理如下:
反应Ⅰ.2NH4Cl+MgO![]() 2NH3↑+MgCl2+H2O↑
2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2![]() 2MgO+2Cl2
2MgO+2Cl2
下列说法正确的是
A. 该工艺中MgO可循环利用
B. 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L
C. 在800~1000℃条件下,O2的还原性强于Cl2的还原性
D. 若反应2NH3+MgCl2+H2O=2NH4Cl+MgO能自发进行,则该反应ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com