
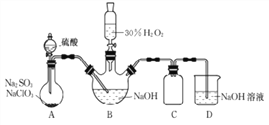
【题目】实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如下图所示)。
已知:
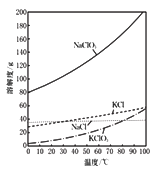
(I)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3·3H2O,高于38℃时析出晶体是NaClO2;
(Ⅱ)30 % H2O2超过40℃时会完全分解;
(Ⅲ)高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置A发生的反应中,还原剂是________。
(2)①装置B中反应生成NaClO2的化学方程式为____________。
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有________、_______。
(3)请补充从装置B反应后的溶液中获得NaClO2晶体的操作步骤。
①在55 ℃时蒸发结晶;②_______;③ ________;④________;得到成品。
(4)装置C的作用是______________。
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性的实验方案是________。(可供选用的试剂:稀H2SO4、FeCl2溶液、KSCN溶液)
【答案】 Na2SO3 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 缓慢滴加硫酸、H2O 装置B加冷水浴等 趁热(不低于38℃)过滤 用38~60℃热水洗涤 低于60℃干燥 防止D中的溶液倒吸到B瓶(或安全瓶)中 加热至40℃至60℃之间除去H2O2,冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性。
【解析】(1)装置A发生的反应是:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+ H2O其中Na2SO3中硫的化合价从+4价升高为+6价,Na2SO3作为还原剂;
(2)①装置B中2ClO2在NaOH和H2O2的作用下反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可以通过缓慢滴加硫酸、H2O而不致温度过高,或在装置B加冷水浴等;
(3)从装置B反应后的溶液中获得NaClO2晶体的操作步骤为:① 在55 ℃时蒸发结晶;②趁热(不低于38℃)过滤;③用38~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)装置D中气体反应,装置内压强降低,装置C防止倒吸;
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性,除去H2O2的干扰后,选择FeCl2溶液,氧化后生成FeCl3,再选择KSCN溶液用于检验产生的FeCl3,实验方案是:加热至40℃至60℃之间除去H2O2,冷却后再加入FeCl2溶液与几滴KSCN溶液,溶液呈血红色,证明NaClO2具有氧化性。


科目:高中化学 来源: 题型:
【题目】1.
硫代硫酸钠是一种重要的化工产品,某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,受热、遇酸均反应,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
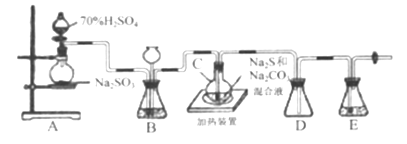
烧瓶C中发生反应如下:
Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
(1)检查装置气密性。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若__________,则整个装置气密性良好:装置E的作用是__________。
(2)按图示加入试剂。向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再加热C,A中反应的化学方程式是______;为提高产品纯度,应使C中Na2CO3和Na2S恰好完全反应,则C烧瓶中Na2CO3和Na2S物质的量之比为_______ 。
(3)装置B的另一作用是观察SO2的生成速率,其中的液体最好选择_____。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中要控制SO2生成速率,使SO2缓慢进入C中可采取的措施有_______;为了保证硫代硫酸钾的产量,该实验一般控制在碱性环境下进行。否则产品发黄,原因是______。
(4)等Na2S和Na2CO3完全消耗后,结束反应。趁热过滤C中混合物,将滤液水浴加热浓缩、_____,经过滤、洗涤、干燥,得到产品。
Ⅲ.[探究与反思]
为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择),若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的碱性溶液中,能大量共存的离子组是
A.Na+、H+、SO42﹣、HCO3﹣ B.Cu2+、K+、SO42﹣、NO3﹣
C.Na+、K+、Cl﹣、NO3﹣ D.Mg2+、K+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列有关两种溶液的说法不正确的是( )
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A. ①②两溶液中c(OH-)相等
B. ①溶液的物质的量浓度为0.01mol·L-1
C. ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D. 等体积的①②两溶液分别与0.01mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中,有下列可逆反应:2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中正确的是
A.该反应的正反应为吸热反应
B.当各物质浓度不再变化时,反应达到平衡状态
C.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动
D.若升高温度,平衡向正反应的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. 常温下铁能被浓硝酸钝化,可用铁制容器贮运浓硝酸
B. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C. 浓硫酸有吸水性,可用于干燥二氧化硫和氨气
D. 金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 二氧化硫和氯气都能使品红溶液褪色
B. 漂白粉暴露在空气中久置会变质
C. 在加热条件下,镁能在二氧化碳气体中燃烧
D. 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·s) B.v(B)=0.3mol/(L·s)
C.v(C)=0.8mol/(L·s) D.v(D)=1mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com