
【题目】某无色透明的碱性溶液中,能大量共存的离子组是
A.Na+、H+、SO42﹣、HCO3﹣ B.Cu2+、K+、SO42﹣、NO3﹣
C.Na+、K+、Cl﹣、NO3﹣ D.Mg2+、K+、SO42﹣、Cl﹣
科目:高中化学 来源: 题型:
【题目】将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为
A. 0.02g B. 0.46g C. 0.80g D. 0.23g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
⑴H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_____________。
⑵20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2的技术:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理净化利用。
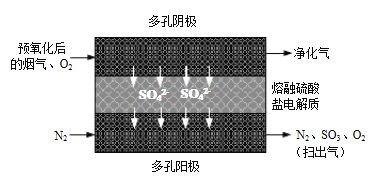
①阴极反应方程式为_____________。
②若电解过程中转移1mol电子,所得“扫出气”用水吸收最多可制得质量分数70%的硫酸_____________g。
⑶利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。
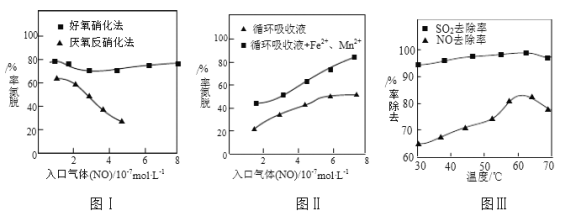
①由图I知,当废气中的NO含量增加时,宜选用____________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为_____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率随温度升高而下降的原因为_____________。
②写出废气中的SO2与NaClO2反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
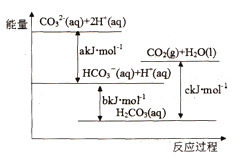
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球影响,以及外界和广口瓶间热量的传递影响)。则所用试剂不可能是
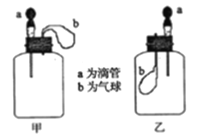
A. 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体)
B. 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气
C. 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液
D. 甲:稀盐酸和大理石粉末(固体);乙:H2O和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaClO3与Na2SO3制取ClO2气体,再由ClO2在强碱性条件下与过量的H2O2反应制得漂白剂NaClO2(装置如下图所示)。
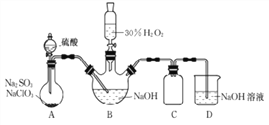
已知:
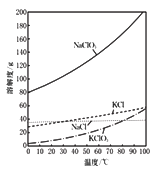
(I)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO3·3H2O,高于38℃时析出晶体是NaClO2;
(Ⅱ)30 % H2O2超过40℃时会完全分解;
(Ⅲ)高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置A发生的反应中,还原剂是________。
(2)①装置B中反应生成NaClO2的化学方程式为____________。
②实验中B装置需进行温度控制不超过40℃,在不改变NaOH溶液浓度和体积的条件下,可采取的措施有________、_______。
(3)请补充从装置B反应后的溶液中获得NaClO2晶体的操作步骤。
①在55 ℃时蒸发结晶;②_______;③ ________;④________;得到成品。
(4)装置C的作用是______________。
(5)证明实验后装置B所得混合溶液中的NaClO2具有氧化性的实验方案是________。(可供选用的试剂:稀H2SO4、FeCl2溶液、KSCN溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.高温高压下可以使石墨转化为金刚石是自发的化学反应
C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.同一物质的固、液、气三种状态的熵值相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com