
【题目】在100mLHNO3和H2SO4混合溶液中,两种酸物质的量浓度之和0.6mol/L,向该溶液中加入足量铜粉,加热,待充分反应后,所得溶液中Cu2+ 的 物质的量浓度(mol/L)最大值为
A.0.225 B.0.30 C.0.36 D.0.45
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】钢铁在潮湿的空气中容易发生电化学腐蚀,其负极反应为
A. Fe-3e-=Fe3+
B. O2+2H2O+4e-=4OH-
C. 2H++2e-=H2↑
D. Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数的说法正确的是( )
A. 在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度
B. 在任何条件下,化学平衡常数是一个恒定值
C. 平衡常数的大小与温度、浓度、压强、催化剂等无关
D. 从平衡常数的大小可以推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】(10分)碳、硫和氮元素及其化合物的处理是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g) + 4H2(g)![]() CH3OCH3(g) + H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1
CH3OCH3(g) + H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线如图1
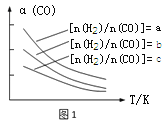
若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”)。
(2)SO2的水溶液呈酸性,某温度下,0.02 molL﹣1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g) + O2(g) 2SO3(g) △H1;
反应2:2NO(g) + O2(g) 2NO2(g) △H2;
反应3:SO2(g) + NO2(g) SO3(g) + NO(g) △H3;
若△H1<△H2<0,则反应3属于 (填“放热”或“吸热”)反应。
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图如图2。电解时阳极的电极反应式为 。
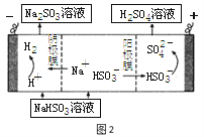
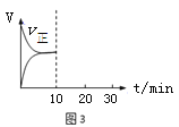
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g) + NO2(g) SO3(g) + NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在图3画出正反应速率v正在10至30min间随时间变化的曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO32﹣
B.NaHSO4═Na++H++SO42﹣
C.Mg(NO3)2═Mg2++2NO3﹣
D.Na2SO4═2Na++SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向1L pH=2的醋酸溶液中加入2L pH=2的盐酸,则混合溶液的pH为(假设混合后溶液体积不变,室温下醋酸的电离平衡常数为1.8×10-5)
A. 2.3 B. 1.7 C. 2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的微型化可有效减少污染,实现化学实验的绿色化。某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O]
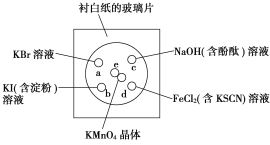
(1)e处发生反应的离子方程式为_______________________,该反应中氧化剂和还原剂的物质的量之比为_____________________。
(2)b处的实验现象为_______________________,
d处的实验现象为______________________。
(3)c处反应的化学方程式为_________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com