
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_____。
(2)加入沸石的作用是_____。若加热后发现未加沸石,应采取的正确方法是______。
(3)上述装置图中,B仪器的名称是_____,D仪器的名称是_____。
(4)分液漏斗使用前必须进行的操作是_____(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_____层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是_____。
(7)本实验中,正丁醛的产率为_____%。
【答案】不能,易迸溅 防止暴沸 冷却后补加 分液漏斗 直形冷凝管 c 下 既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化 51
【解析】
(1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加;
(3)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管;
(4)分液漏斗使用前必须进行的第一项操作是检漏;
(5)正丁醛密度为0.8017g·cm-3,小于水的密度;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90—95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x %,根据关系式
C4H10O -C4H8O
74 72
4x 2
解得:x=51。


科目:高中化学 来源: 题型:
【题目】某兴趣小组用0.50 mol/L KI、0.2%淀粉溶液、0.20 mol/L K2S2O8、0.10 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢)
I2+2S2O32-=2I-+S4O62-(快)
(1)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
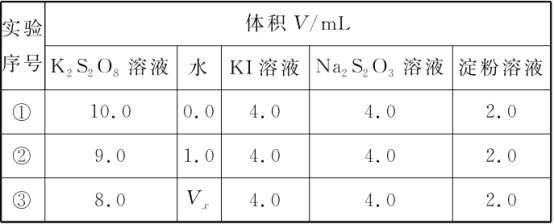
表中Vx=________mL,理由是__________。
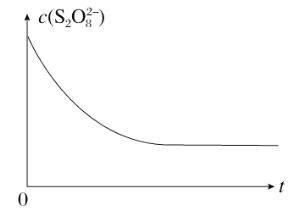
(2)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如下图,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn3O4是一种高性能结构材料,可由含钙镁离子的硫酸锰浸出液为原料制备。其工艺流程如图所示:
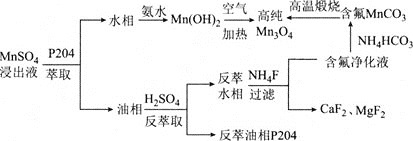
请回答下列问题:
⑴四氧化三锰(Mn3O4)中锰元素的化合价有+2价和+3价,其化学式可改写为________(选项字母)。
A. MnO Mn2O3 B. 2MnO MnO2 C. Mn2O Mn2O3 D. MnO MnO2
⑵是P2O4密度小于水的无色液体,用P2O4萃取碘水中的碘,振荡、静置后的现象为________。
⑶写出由Mn(OH)2制备Mn3O4的化学方程式:________。
⑷通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全。若要除去Ca2+、Mg2+,则残留液中c(F-)应不小于_______ mol·L-1,![]() =________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,
=________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,![]() ,
,![]() ;保留三位有效数字]。
;保留三位有效数字]。
⑸可由“水相”制备高纯度单质锰,装置如图所示:
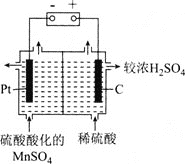
①装置中采用________![]() 填“阴离子”或“阳离子”
填“阴离子”或“阳离子”![]() 交换膜。
交换膜。
②写出该电解反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已成为全球普遍的热门话题。
(1)利用甲烷催化还原氨氧化物。已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H1=-867kJmol-1,CH4(g) +4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H2=-574kJmol-1,则CH4将NO还原为N2的热化学方程式为___。
(2)用NH3催化还原NOX也可以消除氮氧化物的污染.如图采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) +NO2(g) +2NH3(g) 2N2(g)+3H2O(g)。
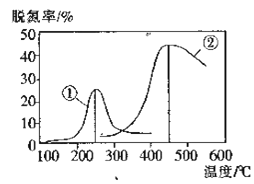
①该反应的△S___0,△H___0(填“>”、“=”或“<”)。
②对于气体反应,用某组分(B)的平衡压强(pB )代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp=______。
③以下说法正确的是___(填标号)。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
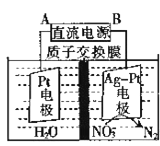
(3)催化反硝化法和电化学沉解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2能NO3-还原为N2,一段时间后,溶液的碱性明显增强,则反应离子方程式为____。
②电化学降解NO3-的原理如图所示。电源正极为______(填A或B),阴极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[双选题]铝-空气原电池通常以![]() 溶液或
溶液或![]() 溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
A.以![]() 溶液或
溶液或![]() 溶液为电解质溶液时,正极的电极反应均为
溶液为电解质溶液时,正极的电极反应均为![]()
B.以溶液为电解质溶液时,负极的电极反应为![]()
C.以![]() 溶液为电解质溶液时,负极的电极反应为
溶液为电解质溶液时,负极的电极反应为![]()
D.以![]() 溶液为电解质溶液时,负极的电极反应
溶液为电解质溶液时,负极的电极反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 温度(℃) | 反应物 | 催化剂 |
① | 20 | 25 mL 3% H2O2溶液 | 无 |
② | 20 | 25 mL 5% H2O2溶液 | 无 |
③ | 20 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
④ | 20 | 25 mL 5% H2O2溶液 | 1~2滴1mol/L FeCl3溶液 |
⑤ | 30 | 25 mL 5% H2O2溶液 | 0.1g MnO2 |
(1)实验①和②的目的是____________________________。同学甲在进行实验时并没有观察到明显现象。资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是__________(写出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是__________________________,__________________________;

(3)写出实验③中H2O2分解的化学方程式:______________________________;
(4)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析。以生成10mL气体为准,其他影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是______________。
(5)某反应在体积为2L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知X、Y、Z均为气体).

①该反应的化学方程式为______.
②反应开始至2分钟时,Y的平均反应速率为______.
③能说明该反应已达到平衡状态的是______
A.υ(X)=3υ(Y)B.容器内气体密度不变
C.υ逆(Z)=2υ正(Y)D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
④由图求得平衡时X的转化率为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com