
【题目】Mn3O4是一种高性能结构材料,可由含钙镁离子的硫酸锰浸出液为原料制备。其工艺流程如图所示:
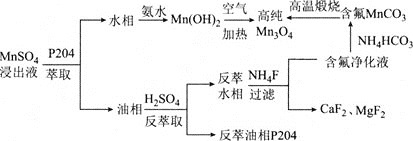
请回答下列问题:
⑴四氧化三锰(Mn3O4)中锰元素的化合价有+2价和+3价,其化学式可改写为________(选项字母)。
A. MnO Mn2O3 B. 2MnO MnO2 C. Mn2O Mn2O3 D. MnO MnO2
⑵是P2O4密度小于水的无色液体,用P2O4萃取碘水中的碘,振荡、静置后的现象为________。
⑶写出由Mn(OH)2制备Mn3O4的化学方程式:________。
⑷通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全。若要除去Ca2+、Mg2+,则残留液中c(F-)应不小于_______ mol·L-1,![]() =________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,
=________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,![]() ,
,![]() ;保留三位有效数字]。
;保留三位有效数字]。
⑸可由“水相”制备高纯度单质锰,装置如图所示:
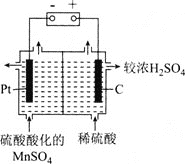
①装置中采用________![]() 填“阴离子”或“阳离子”
填“阴离子”或“阳离子”![]() 交换膜。
交换膜。
②写出该电解反应的化学方程式:________。
【答案】A 液体分层,上层为紫红色,下层为无色 6Mn(OH)2 + O2 = 2Mn3O4 + 6H2O 2.55×10-2 4.15×10-3 阴离子 2MnSO4 + 2H2O ![]() 2Mn + O2↑+ 2H2SO4
2Mn + O2↑+ 2H2SO4
【解析】
⑴四氧化三锰(Mn3O4)中锰元素的化合价有+2价和+3价改写;
⑵P2O4密度比水小,若用P2O4萃取碘水中的碘,液体分层,上层为紫红色,下层为无色;
⑶Mn(OH)2和氧气中加热生成Mn3O4,根据得失电子守恒,元素守恒写出化学方程式;
⑷若要除去Ca2+、Mg2+,Ca2+、Mg2+离子浓度小于1×10-5 mol·L-1,且氟化镁的溶度积更大一些,则根据氟化镁的溶度积计算,残留液中c(F-),根据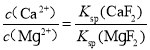 进行计算;
进行计算;
⑸①Mn2+在电解池的阴极得电子生成单质锰,需要用阴离子交换膜;②Mn2+在电解池得阴极的电子生成单质锰,水中的氢氧根在阳极失电子生成氧气,再写出总反应方程式。
⑴四氧化三锰(Mn3O4)中锰元素的化合价有+2价和+3价,根据化合价改写为MnOMn2O3,因此A正确,故答案为:A。
⑵P2O4密度比水小,若用P2O4萃取碘水中的碘,振荡、静置后的现象为液体分层,则现象是上层为紫红色,下层为无色;故答案为:液体分层,上层为紫红色,下层为无色;
⑶Mn(OH)2在空气中加热生成Mn3O4,反应物是Mn(OH)2和氧气,根据得失电子守恒,元素守恒,化学方程式为6Mn(OH)2 + O2 = 2Mn3O4 + 6H2O;故答案为:6Mn(OH)2 + O2 = 2Mn3O4 + 6H2O;
⑷若要除去Ca2+、Mg2+,Ca2+、Mg2+离子浓度小于1×10-5 mol·L-1,且氟化镁的溶度积更大一些,则根据氟化镁的溶度积计算,所以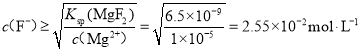 ,则残留液中c(F-)应不小于2.55×10-2 mol·L-1,
,则残留液中c(F-)应不小于2.55×10-2 mol·L-1,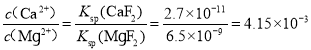 ;故答案为:2.55×10-2;4.15×10-3;
;故答案为:2.55×10-2;4.15×10-3;
⑸①若想制备高纯度单质锰,则需要Mn2+在电解池的阴极的电子生成单质锰,需要用阴离子交换膜;故答案为:阴离子。
②Mn2+在电解池的阴极得电子生成单质锰,水中的氢氧根在阳极失电子生成氧气,所以该电解反应的化学方程式:2MnSO4 + 2H2O ![]() 2Mn + O2↑+ 2H2SO4;故答案为:2MnSO4 + 2H2O
2Mn + O2↑+ 2H2SO4;故答案为:2MnSO4 + 2H2O ![]() 2Mn + O2↑+ 2H2SO4。
2Mn + O2↑+ 2H2SO4。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】常温时,1 mol·L-1的HClO2和1 mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是( )

A.在0≤pH≤5时,HMnO4溶液满足pH=lg![]() +1
+1
B.当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C.稀释前分别用1 mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
D.当稀释至pH均为3时,HMnO4溶液中的V等于1000 V0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像符合题意的是
A.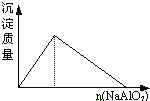 盐酸溶液中逐滴加入NaAlO2
盐酸溶液中逐滴加入NaAlO2
B.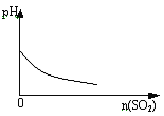 SO2气体逐渐通入溴水中
SO2气体逐渐通入溴水中
C.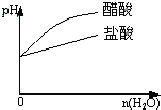 pH=1的醋酸与盐酸溶液分别加水稀释
pH=1的醋酸与盐酸溶液分别加水稀释
D.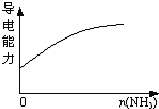 氨气逐渐通入醋酸中
氨气逐渐通入醋酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到目的的是
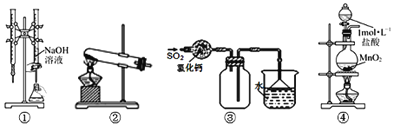
A.装置①可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验
B.装置②可用于氯化铵固体和氢氧化钙固体反应制取少量氨气
C.装置③可用于收集SO2,并吸收多余的SO2
D.装置④可用于制取少量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
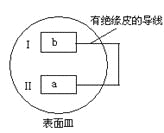
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_____。
(2)加入沸石的作用是_____。若加热后发现未加沸石,应采取的正确方法是______。
(3)上述装置图中,B仪器的名称是_____,D仪器的名称是_____。
(4)分液漏斗使用前必须进行的操作是_____(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_____层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是_____。
(7)本实验中,正丁醛的产率为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2 (g) △H1 ②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3 ④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是( )
A.△H1>0,△H3<0B.△H2>0,△H3>0
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com