
【题目】下列图像符合题意的是
A.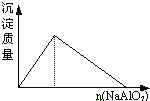 盐酸溶液中逐滴加入NaAlO2
盐酸溶液中逐滴加入NaAlO2
B.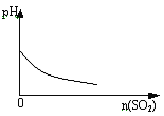 SO2气体逐渐通入溴水中
SO2气体逐渐通入溴水中
C.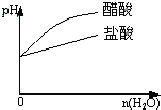 pH=1的醋酸与盐酸溶液分别加水稀释
pH=1的醋酸与盐酸溶液分别加水稀释
D.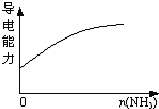 氨气逐渐通入醋酸中
氨气逐渐通入醋酸中
【答案】D
【解析】
A.盐酸中逐滴加入NaAlO2溶液,生成的沉淀立即溶解,反应离子方程式为AlO2-+4H+ =Al3++H2O,当AlO2-过量后才会生成沉淀,选项A错误;
B.溴水中存在反应:Br2+H2O![]() HBr+HBrO,所以溴水呈酸性,起始时溶液pH<7,通入二氧化硫发生反应:Br2+SO2+H2O=H2SO4+2HBr,H2SO4和HBr均为强酸,所以通SO2后,溶液酸性增强,pH减小,选项B错误;
HBr+HBrO,所以溴水呈酸性,起始时溶液pH<7,通入二氧化硫发生反应:Br2+SO2+H2O=H2SO4+2HBr,H2SO4和HBr均为强酸,所以通SO2后,溶液酸性增强,pH减小,选项B错误;
C.pH相同的盐酸与醋酸,起始时c(H+)相同,但醋酸中有未电离的CH3COOH分子,加水稀释,醋酸中未电离的CH3COOH将继续电离补充H+,所以稀释相同倍数后,醋酸中c(H+)大,pH小,但二者无论如何稀释,pH都不会超过7,选项C错误;
D.醋酸是弱电解质,导电能力弱,通入氨气后生成醋酸铵,醋酸铵为强电解质,所以导电能力增强,选项D正确。
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含如下离子组中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,且物质的量浓度相同。某同学欲探究该溶液的组成,进行如下实验:
,且物质的量浓度相同。某同学欲探究该溶液的组成,进行如下实验:
Ⅰ![]() 用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ![]() 另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成
Ⅲ![]() 取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入
取Ⅱ反应后的溶液分置于两支试管中,第一支试管中加入![]() 溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入
溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入![]() ,充分振荡静置后溶液分层,下层出现紫红色。下列说法正确的是
,充分振荡静置后溶液分层,下层出现紫红色。下列说法正确的是![]()
A.原溶液中![]() 和
和![]() 至少有一种,一定没有
至少有一种,一定没有![]() 、
、![]()
B.步骤Ⅱ中无色气体可能含有![]() ,原溶液中可能含有
,原溶液中可能含有![]()
C.原溶液中肯定含有![]() 、
、![]()
D.为确定是否含有![]() ,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀
,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2003年3月,日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在 5K 下呈现超导性。报报道,该晶体中含有最简式为 CoO2的层状结构,结构如右图(小球表示Co原子,大球表示O原子)。
下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是
A.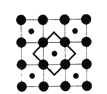 B.
B.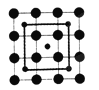
C.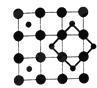 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
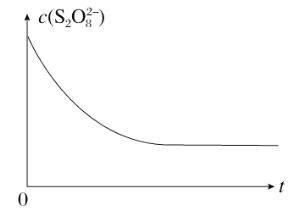
【题目】某兴趣小组用0.50 mol/L KI、0.2%淀粉溶液、0.20 mol/L K2S2O8、0.10 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢)
I2+2S2O32-=2I-+S4O62-(快)
(1)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
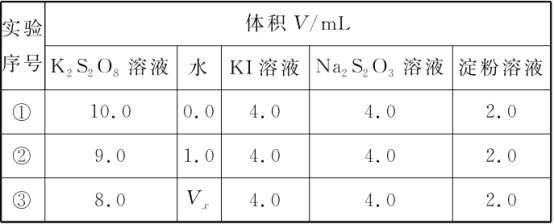
表中Vx=________mL,理由是__________。
(2)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如下图,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机物的结构,用核磁共振仪处理后得到如图所示的核磁共振氢谱,则该有机物可能是()
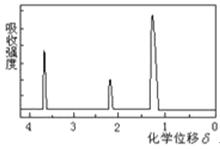
A.C2H5OH
B.![]()
C.CH3CH2CH2COOH
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图象如下,下列判断正确的是

A.由图1可知,![]() ,该反应正反应为吸热反应
,该反应正反应为吸热反应
B.由图2可知,该反应![]()
C.图3中,点3的反应速率:v正>v逆
D.图4中,若![]() ,则a曲线一定使用了催化剂
,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn3O4是一种高性能结构材料,可由含钙镁离子的硫酸锰浸出液为原料制备。其工艺流程如图所示:
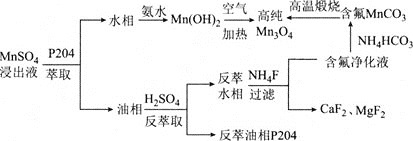
请回答下列问题:
⑴四氧化三锰(Mn3O4)中锰元素的化合价有+2价和+3价,其化学式可改写为________(选项字母)。
A. MnO Mn2O3 B. 2MnO MnO2 C. Mn2O Mn2O3 D. MnO MnO2
⑵是P2O4密度小于水的无色液体,用P2O4萃取碘水中的碘,振荡、静置后的现象为________。
⑶写出由Mn(OH)2制备Mn3O4的化学方程式:________。
⑷通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全。若要除去Ca2+、Mg2+,则残留液中c(F-)应不小于_______ mol·L-1,![]() =________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,
=________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,![]() ,
,![]() ;保留三位有效数字]。
;保留三位有效数字]。
⑸可由“水相”制备高纯度单质锰,装置如图所示:
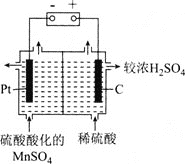
①装置中采用________![]() 填“阴离子”或“阳离子”
填“阴离子”或“阳离子”![]() 交换膜。
交换膜。
②写出该电解反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com