
【题目】某有机物样品3 g充分燃烧后,得到4.4 g CO2和1.8 g H2O ,实验测得其相对分子质量为60,求该有机物的分子式。
【答案】C2H4O2
【解析】
先计算CO2、H2O的物质的量,得到C、H的物质的量,然后计算其中含有C、H的质量,用总质量减去C、H质量就是O元素的质量,得到C、H、O的质量比及物质的量的比,可得最简式,然后根据最简式的式量、相对分子质量关系,得到物质的分子式。
有机物燃烧产生CO2的物质的量为n(CO2)=![]() =0.1 mol,n(C)= n(CO2)=0.1mol,则m(C)=0.1 mol×12 g/mol=1.2 g;有机物燃烧产生H2O的物质的量为n(H2O)=
=0.1 mol,n(C)= n(CO2)=0.1mol,则m(C)=0.1 mol×12 g/mol=1.2 g;有机物燃烧产生H2O的物质的量为n(H2O)=![]() =0.1 mol,n(H)=2n(H2O)=2×0.1 mol=0.2 mol,则m(H)=0.2 mol×1 g/mol=0.2 g,m(C)+m(H)=1.2 g+0.2 g=1.4 g<3 g,说明有机物中含有O原子,其质量m(O)=3 g-1.2 g-0.2 g=1.6 g,所以n(O)=
=0.1 mol,n(H)=2n(H2O)=2×0.1 mol=0.2 mol,则m(H)=0.2 mol×1 g/mol=0.2 g,m(C)+m(H)=1.2 g+0.2 g=1.4 g<3 g,说明有机物中含有O原子,其质量m(O)=3 g-1.2 g-0.2 g=1.6 g,所以n(O)=![]() =0.1 mol;n(C):n(H):n(O)=0.1:0.2:0.1=1:2:1,物质最简式是CH2O,最简式的式量是30,设物质分子式是(CH2O)n,该物质相对分子质量是60,30n=60,所以n=2,故该物质分子式是C2H4O2。
=0.1 mol;n(C):n(H):n(O)=0.1:0.2:0.1=1:2:1,物质最简式是CH2O,最简式的式量是30,设物质分子式是(CH2O)n,该物质相对分子质量是60,30n=60,所以n=2,故该物质分子式是C2H4O2。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
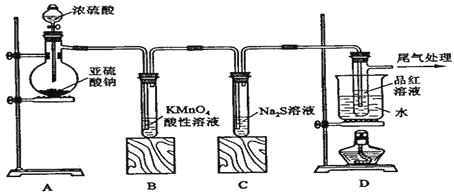
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是( )

A.电池工作时,OH—从左向右迁移
B.电极A上发生氧化反应,电极A为正极
C.当有0.1molNO2被处理时,外电路中通过电子0.4mol
D.电极B的电极反应式为2NO2+8e-+8H+=N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑酸钠(NaSbO3)具有广泛的应用,可用作显像管、光学玻璃和各种高级玻璃的澄清剂,纺织品、塑料制品的阻燃剂,搪瓷乳白剂,制造铸件用漆的不透明填料及铁皮、钢板抗酸漆的成分。工业上用双氧水氧化法制备NaSbO33H2O的工艺流程如下:
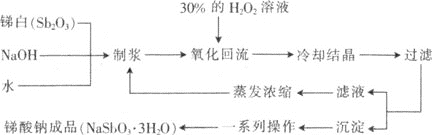
回答下列问题:
⑴NaSbO33H2O中Sb的化合价为________。
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是________。
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是________。此过程中涉及反应如下,配平此化学方程式:
____Sb2O3 + ____H2O2 + ____NaOH + ____H2O = ____NaSbO33H2O。
⑷此流程中,可以循环利用的主要物质有________。
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括________,产品在90~100℃下烘干,温度不宜太高的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像符合题意的是
A.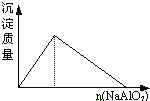 盐酸溶液中逐滴加入NaAlO2
盐酸溶液中逐滴加入NaAlO2
B.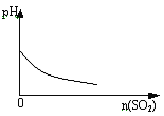 SO2气体逐渐通入溴水中
SO2气体逐渐通入溴水中
C.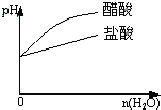 pH=1的醋酸与盐酸溶液分别加水稀释
pH=1的醋酸与盐酸溶液分别加水稀释
D.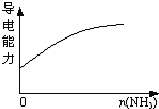 氨气逐渐通入醋酸中
氨气逐渐通入醋酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
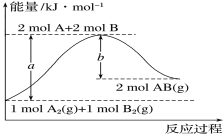
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
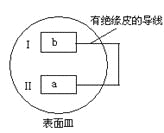
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0,在其他条件不变时,
2SO3(g);ΔH<0,在其他条件不变时,
①升温反应速率________,增大压强反应速率________;
②达到化学平衡时,v正(SO2)________(填“大于”“小于”或“等于”)v逆(SO3);若平衡后增加O2的浓度,平衡向________方向移动,SO2的转化率________;若升高温度,则平衡向________方向移动。
(2)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了![]() nmol,C增加了
nmol,C增加了![]() nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com