
【题目】(1)可逆反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0,在其他条件不变时,
2SO3(g);ΔH<0,在其他条件不变时,
①升温反应速率________,增大压强反应速率________;
②达到化学平衡时,v正(SO2)________(填“大于”“小于”或“等于”)v逆(SO3);若平衡后增加O2的浓度,平衡向________方向移动,SO2的转化率________;若升高温度,则平衡向________方向移动。
(2)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了![]() nmol,C增加了
nmol,C增加了![]() nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
【答案】增大 增大 等于 正反应 增大 逆反应 2 1 3 2
【解析】
(1)①升高温度、增大压强,反应速率都增大;
②达到平衡时,正反应速率=逆反应速率;增大反应物浓度,平衡正向移动,另一个反应物的转化率增大;升高温度,平衡向吸热反应的方向移动;
(2)同一反应同一时间段内,参加反应的各物质的物质的量之比等于其化学计量数之比。
(1)①无论反应是放热反应或吸热反应,升高温度,反应速率均增大;对于有气体参与的反应,增大压强,反应速率增大;
②达到平衡后,各组成的浓度不再改变,则v正(SO2)等于v逆(SO3);增大反应物的浓度,平衡向正反应方向移动,另一个反应物消耗更多,则SO2的转化率增大;该反应正反应为放热反应,若升高温度,平衡向着反应吸热方向移动,即向逆反应方向移动;
(2)同一反应同一时间段内,参加反应的各物质的物质的量之比等于其化学计量数之比,则
![]() ,则:a=2,b=1,c=3,d=2。
,则:a=2,b=1,c=3,d=2。


科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆方向移动
B.加入少量NaOH固体,平衡向正方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[双选题]铝-空气原电池通常以![]() 溶液或
溶液或![]() 溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
A.以![]() 溶液或
溶液或![]() 溶液为电解质溶液时,正极的电极反应均为
溶液为电解质溶液时,正极的电极反应均为![]()
B.以溶液为电解质溶液时,负极的电极反应为![]()
C.以![]() 溶液为电解质溶液时,负极的电极反应为
溶液为电解质溶液时,负极的电极反应为![]()
D.以![]() 溶液为电解质溶液时,负极的电极反应
溶液为电解质溶液时,负极的电极反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融碳酸盐燃料电池的电解质为![]() 和
和![]() 的混合物,燃料为
的混合物,燃料为![]() ,氧化剂是含
,氧化剂是含![]() 的
的![]() ,两个电极均为惰性电极,在工作过程中,电解质熔融液的组成、相对浓度都不变。试回答:
,两个电极均为惰性电极,在工作过程中,电解质熔融液的组成、相对浓度都不变。试回答:
(1)负极的电极反应为________________;
(2)正极的电极反应为________________;
(3)工作时熔融液中的________________向负极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆![]() 主要成分为MnO2,含少量Al2O3、Fe2O3、Fe2O、SiO2等杂质
主要成分为MnO2,含少量Al2O3、Fe2O3、Fe2O、SiO2等杂质![]() 为原料制备锰酸锂的流程如下图所示。
为原料制备锰酸锂的流程如下图所示。
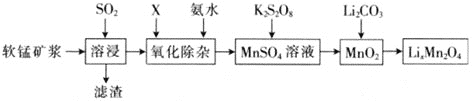
⑴溶浸过程中,为提高SO2吸收率,可采取的措施有________![]() 填字母
填字母![]() 。
。
a.不断搅拌,使SO2和软锰矿浆充分接触 b. 增大通入SO2的速率
c. 减小软锰矿浆的进入量 d. 减小通入SO2的速率
⑵已知:室温下,Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =1×10-39,pH =7.1时Mn(OH)2开始沉淀。氧化除杂(室温)是除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6 mol·L-1),则需调节溶液pH的范围为________。
⑶硫酸锰与K2S2O8溶液在常温下混合一周,可慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式:________。
⑷将MnO2和Li2CO3按物质的量4:1进行配料,充分搅拌,混合均匀然后升温至600~700℃,制取产品LiMn2O4。写出该反应的化学方程式:________。该反应中氧化剂为_______(填化学式)。
⑸锰酸锂可充电电池的总反应为Li1-xMn2O4 + LixC![]() LiMn2O4 + C(0 < x < 1)。
LiMn2O4 + C(0 < x < 1)。

①充电时,电池的阳极反应式为________。
②废旧锰酸锂电池中可能残留单质锂,拆解不当易着火、爆炸,为了安全,拆解的注意事项是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见无机物A、B、C、D存在如图转化关系:
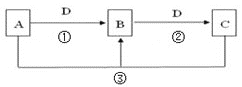
(1)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一![]() 遇空气会变色,则反应
遇空气会变色,则反应![]() 的化学方程式为_________________________________________________。
的化学方程式为_________________________________________________。
(2)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,则B的化学式是_____________________。
(3)若A、C、D都是常见气体,C是形成酸雨的主要气体,则A的电子式是____________。
(4)若A、B、C的水溶液均显碱性,焰色反应均为黄色,D为![]() ,举出C的一种用途_______________________。
,举出C的一种用途_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com