
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆![]() 主要成分为MnO2,含少量Al2O3、Fe2O3、Fe2O、SiO2等杂质
主要成分为MnO2,含少量Al2O3、Fe2O3、Fe2O、SiO2等杂质![]() 为原料制备锰酸锂的流程如下图所示。
为原料制备锰酸锂的流程如下图所示。
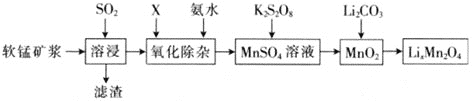
⑴溶浸过程中,为提高SO2吸收率,可采取的措施有________![]() 填字母
填字母![]() 。
。
a.不断搅拌,使SO2和软锰矿浆充分接触 b. 增大通入SO2的速率
c. 减小软锰矿浆的进入量 d. 减小通入SO2的速率
⑵已知:室温下,Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =1×10-39,pH =7.1时Mn(OH)2开始沉淀。氧化除杂(室温)是除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6 mol·L-1),则需调节溶液pH的范围为________。
⑶硫酸锰与K2S2O8溶液在常温下混合一周,可慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式:________。
⑷将MnO2和Li2CO3按物质的量4:1进行配料,充分搅拌,混合均匀然后升温至600~700℃,制取产品LiMn2O4。写出该反应的化学方程式:________。该反应中氧化剂为_______(填化学式)。
⑸锰酸锂可充电电池的总反应为Li1-xMn2O4 + LixC![]() LiMn2O4 + C(0 < x < 1)。
LiMn2O4 + C(0 < x < 1)。

①充电时,电池的阳极反应式为________。
②废旧锰酸锂电池中可能残留单质锂,拆解不当易着火、爆炸,为了安全,拆解的注意事项是________。
【答案】ad 5.0 < pH < 7.1 Mn2+ + S2O82- +2 H2O = MnO2↓+4H+ + 2 SO42- 8MnO2 +2 Li2CO3![]() 4LiMn2O4 + 2CO2↑+ O2↑ MnO2 LiMn2O4-xe- = Li1-xMn2O4 + xLi+ 拆解环境保持干燥,拆解下的锂隔绝空气保存
4LiMn2O4 + 2CO2↑+ O2↑ MnO2 LiMn2O4-xe- = Li1-xMn2O4 + xLi+ 拆解环境保持干燥,拆解下的锂隔绝空气保存
【解析】
⑴溶浸过程中可以采取的措施不断搅拌使SO2和软锰矿浆充分接触或减小通入SO2的流速;
⑵除杂时显然只能除去Fe3+、Al3+,不能损失Mn2+,pH应该小于Mn(OH)2开始沉淀时的pH值,大于Fe3+、Al3+完全变成沉淀时的pH值,根据溶度积算出Fe3+、Al3+完全变成沉淀时的pH值;
⑶由题意可知,反应物为硫酸锰与K2S2O8,生成物之一为MnO2,再根据化合价升降相等和原子守恒配平离子反应方程式;
⑷将MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成。
⑸①放电时,先写出电池的正极发生还原反应,再写出充电时电池的阳极反应式;②废旧锰酸锂电池可能残留有单质锂,锂化学性质活泼,锂可与空气中的O2和H2O反应。
⑴溶浸过程中,为提高SO2吸收率可采取的措施:可以采取的措施不断搅拌,使SO2和软锰矿浆充分接触或减小通入SO2的流速;故选ad;
⑵除杂时显然只能除去Fe3+、Al3+,不能损失Mn2+。由题意可知,室温下,pH =7.1时Mn(OH)2开始沉淀,除去MnSO4溶液中的Fe3+、Al3+,Al3+完全变成沉淀时的pH:Ksp[Al(OH)3] =1×10-33 = c(Al3+)×c3(OH-),c(Al3+)= 1×10-6 mol·L-1,解得c(OH-) =1×10-6 mol·L-1,c(H+)= 1×10-5 mol·L-1,pH = 5,同理Fe3+完全变成沉淀时,Ksp[Fe(OH)3] =1×10-39 = c(Fe3+)×c3(OH-),c(OH-) =1×10-11 mol·L-1,c(H+)= 1×10-3 mol·L-1,pH = 3,故pH范围是5.0 < pH < 7.1,故答案为:5.0 < pH < 7.1;
⑶由题意可知,反应物为硫酸锰与K2S2O8,生成物之一为MnO2,再根据化合价升降相等和原子守恒配平,则发生反应的离子反应方程式为Mn2+ + S2O82-+2 H2O = MnO2↓+4H+ + 2 SO42-;故答案为:Mn2+ + S2O82-+2 H2O = MnO2↓+4H+ + 2 SO42-;
⑷将MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成。该反应的方程式为:8MnO2 +2 Li2CO3![]() 4LiMn2O4 + 2CO2↑+ O2↑;MnO2中Mn元素被还原,是氧化剂;故答案为:8MnO2 +2 Li2CO3
4LiMn2O4 + 2CO2↑+ O2↑;MnO2中Mn元素被还原,是氧化剂;故答案为:8MnO2 +2 Li2CO3![]() 4LiMn2O4 + 2CO2↑+ O2↑;MnO2;
4LiMn2O4 + 2CO2↑+ O2↑;MnO2;
⑸①放电时,电池的正极发生还原反应,反应式为Li1-xMn2O4 + xLi+ + xe- = LiMn2O4,充电时电池的阳极反应式为:LiMn2O4 -xe- = Li1-xMn2O4 + xLi+;故答案为:LiMn2O4-xe- = Li1-xMn2O4 + xLi+。
②废旧锰酸锂电池可能残留有单质锂,锂化学性质活泼,锂可与空气中的O2和H2O反应,对拆解的要求是:拆解环境保持干燥,拆解下的锂隔绝空气保存;故答案为:拆解环境保持干燥,拆解下的锂隔绝空气保存。


科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
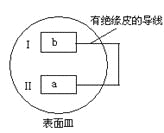
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0,在其他条件不变时,
2SO3(g);ΔH<0,在其他条件不变时,
①升温反应速率________,增大压强反应速率________;
②达到化学平衡时,v正(SO2)________(填“大于”“小于”或“等于”)v逆(SO3);若平衡后增加O2的浓度,平衡向________方向移动,SO2的转化率________;若升高温度,则平衡向________方向移动。
(2)将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了nmol,B减少了![]() nmol,C增加了
nmol,C增加了![]() nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
nmol,D增加了nmol,此时达到化学平衡,该化学方程式中各物质的系数为:a=______、b=______、c=______、d=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是( )
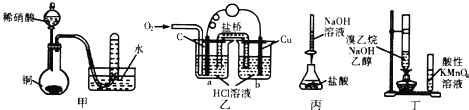
A.用甲装置验证铜与稀硝酸的反应产物是NO
B.通过乙装置实现化学反应:2Cu+O2+4H+=2Cu2++2H2O
C.用丙装置测定盐酸的浓度
D.用丁装置检验溴乙烷与NaOH醇溶液共热有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[双选题]铝-空气原电池通常以![]() 溶液或
溶液或![]() 溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法不正确的是( )
A.以![]() 溶液或
溶液或![]() 溶液为电解质溶液时,正极的电极反应均为
溶液为电解质溶液时,正极的电极反应均为![]()
B.以溶液为电解质溶液时,负极的电极反应为![]()
C.以![]() 溶液为电解质溶液时,负极的电极反应为
溶液为电解质溶液时,负极的电极反应为![]()
D.以![]() 溶液为电解质溶液时,负极的电极反应
溶液为电解质溶液时,负极的电极反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+O2(g)=CO2 (g) △H1 ②CO2(g)+C(s)=2CO(g) △H2
③2CO(g)+O2(g)=2CO2(g) △H3 ④4Fe(s)+3O2(g)=2Fe2O3(s) △H4
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是( )
A.△H1>0,△H3<0B.△H2>0,△H3>0
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.40gNaOH中含有的共用电子对数为2NA
B.常温常压下,1.8g甲基(—CD3)中含有的中子数为0.9NA
C.31g白磷(![]() )含有共价键的总数为6NA
)含有共价键的总数为6NA
D.标况下,22.4LH2O中所含氢氧键的数目约为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机物质的分子式采取适当变形会简化计算。下列计算中错误的是
A.Wg 葡萄糖充分燃烧后,燃烧产物和足量的Na2O2充分反应,固体质量增加 Wg
B.等质量的甲烷、乙烯、乙炔充分燃烧,消耗的氧气的物质的量依次增多
C.乙酸和两种链状单烯烃混合物中氧的质量分数为 a,则碳的质量分数是![]()
D.等物质的量的乙醇与丙烯酸(CH2=CH-COOH)充分燃烧,消耗的氧气的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法不正确的是( )
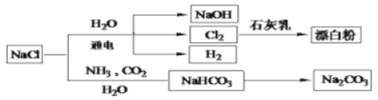
A.以电解饱和食盐水为基础制取氯气等产品的工业称为氯碱工业
B.用石灰乳与Cl2制取的漂白粉的有效成分是Ca(ClO)2
C.Cl2不与铁反应,因此液氯可储存在钢瓶中
D.侯氏制碱法实现了从NaCl到Na2CO3的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com