
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析正确的是( )

A. HR为强酸
B. a、b两点所示溶液中水的电离程度相同
C. b点溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+)
)>c(R-)、c(OH-)>c(H+)
D. a~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
【答案】D
【解析】A.根据图知,0.1mol/L的HR溶液pH>1,说明HR部分电离,则HR为弱酸,A错误;B.酸或碱抑制水电离,且酸中c(H+)越大、碱中c(OH-)越大,其抑制水电离程度越大,含有弱离子的盐促进水电离,a溶液呈酸性抑制水电离,b点溶液恰好反应,生成的盐水解,促进水的电离,B错误;C.b点溶液的pH=7,则溶液中存在c(H+)=c(OH-),结合电荷守恒得c(NH4+)=c(R-),该点溶液中水电离程度很小,所以离子浓度大小顺序是c(NH4+)=c(R-)>c(OH-)=c(H+),C错误;D.离子积常数只与温度有关,温度不变,离子积常数不变,所以这几点溶液中离子积常数不变,D正确;答案选D。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】关于键长、键能和键角的说法中不正确的是
A. 键角是描述分子立体结构的重要参数B. 键长的大小与成键原子的半径有关
C. 多原子分子的键角一定,表明共价键具有方向性D. 键能越大,键长就越长,共价化合物也就越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CO中存在配位键的是
A. ①② B. ①②③ C. ③④⑤ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3发生反应生成Al2O3,反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。下列有关说法中不正确的是

A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)![]() Al2O3(s) ΔH =-1559.5 kJ·mol-1
Al2O3(s) ΔH =-1559.5 kJ·mol-1
B. 等质量的O2比O3的能量低
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. 给3O2(g)![]() 2O3(g)的平衡体系加热,有利于O3的生成
2O3(g)的平衡体系加热,有利于O3的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )

A. N4属于一种新型的化合物
B. N4的沸点比P4(白磷)的高
C. 理论上可以将N4转化为N2的反应设计成原电池
D. 1mol N4所含有的能量比2mol N2所含有的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
0.015时发生的反应是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
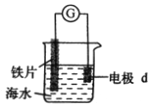
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+2H2O+4e ═ 4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++2e ═ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。

(l)T℃时,将0.6mol NO和0.2 mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图甲所示。
①T℃时,反应3NO(g)+O3(g) ![]() 3NO2(g)的平衡常数K=________.
3NO2(g)的平衡常数K=________.
②不能说明反应达到平衡状态的是_________(填序号).
A.气体颜色不再改变
B.气体的平均摩尔质量不再改变
C.气体的密度不再改变
D.单位时间内生成O3和NO2物质的量之比为1:3
(2)已知2NO2![]() N2O4,如图乙所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊,关闭K2,各将1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为
N2O4,如图乙所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊,关闭K2,各将1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为![]() L(忽略导管中的气体体积).
L(忽略导管中的气体体积).

①若容器A中到达平衡所需时间![]() s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率
s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率![]() _____________________.
_____________________.
②若打开K2,平衡后B容器的体积缩至0.4![]() L,则打开K2之前,气球B体积为_________L.
L,则打开K2之前,气球B体积为_________L.
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数___________(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案能达到实验目的的是( )
A. 用浓硫酸干燥氨气B. 用乙醇萃取碘水中的碘单质
C. 用品红溶液鉴别SO2和CO2D. 用焰色反应鉴别NaCl和NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com