
【题目】(1)在KCl和CaCl2 所组成的某混合物中,K+ 与Ca2+ 的物质的量之比为1∶2,则该混合物中含CaCl2的质量分数为 _______,含1molCl- 的该混合物的质量是____________g。
(2)在标准状况下,由CO 和CO2 组成的混合气体13.44L,质量为20g,该混合气体中,碳与氧两种原子的数目之比为 ____________________。
(3)在某未知体积的NaOH溶液中,经测定含有6.02×1023个OH—,则OH—的物质的量为_______,此溶液中溶质的质量为_______.。
【答案】74.9% 59.3g 3:4 1 40g
【解析】
(1)由化学式可知n(KCl)=n(K+),n(CaCl2)=n(Ca2+),故n(KCl):n(CaCl2)=n(K+):n(Ca2+)=1:2,令氯化钙的物质的量为2xmol,则氯化钾为xmol,根据氯离子可知,4x+x=1,解得x=0.2,故m(KCl)=0.2mol×74.5mol/L=14.9g,m(CaCl2)=0.2mol×2×111g/mol/L=44.4g,CaCl2的质量分数为:![]() =74.9%,故含1mol氯离子的该混合物的质量为14.9g+44.4g=59.3g,故答案为:74.9%;59.3;
=74.9%,故含1mol氯离子的该混合物的质量为14.9g+44.4g=59.3g,故答案为:74.9%;59.3;
(2)在标准状况下,13.44LCO和CO2组成的混合气体的物质的量为:![]() =0.6mol,设CO和CO2的物质的量分别为xmol、ymol,则:x+y=0.6、28x+44y=20,解得:x=0.4,y=0.2,根据N=nNA可知,碳与氧两种原子的数目之比等于其物质的量之比,所以混合气体中C和O两种原子的数目之比为(0.4+0.2):(0.4+2×0.2)=3:4,故答案为:3:4;
=0.6mol,设CO和CO2的物质的量分别为xmol、ymol,则:x+y=0.6、28x+44y=20,解得:x=0.4,y=0.2,根据N=nNA可知,碳与氧两种原子的数目之比等于其物质的量之比,所以混合气体中C和O两种原子的数目之比为(0.4+0.2):(0.4+2×0.2)=3:4,故答案为:3:4;
(3)6.02×1023个OH-的物质的量为![]() =1mol,故n(NaOH)=n(OH-)=1mol,所以氢氧化钠的质量为:1mol×40g/mol=40g,故答案为:1;40。
=1mol,故n(NaOH)=n(OH-)=1mol,所以氢氧化钠的质量为:1mol×40g/mol=40g,故答案为:1;40。


科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
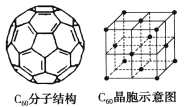
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1 mol·L1。下面四个选项中能达到此目的的是( )
A. Na+、K+、![]() 、ClB. Cu2+、K+、
、ClB. Cu2+、K+、![]() 、
、![]()
C. H+、K+、![]() 、ClD. Mg2+、Na+、Cl、
、ClD. Mg2+、Na+、Cl、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1000mL、密度1.192g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为_____mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中____L的CO2(标准状况)而变质。(已知:CO2+2NaClO+H2O=Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480mL含25%NaClO的消毒液。下列说法正确的是____。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)现有四种有机物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥ ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一个国家的石油化工生产水平的是__________(填序号),该物质可用于制备常用塑料,其反应化学方程式是_______________________。
(2)能用来制取梯恩梯(TNT)的是________(填序号),其发生反应的化学方程式是__________________;
(3)上述有机物能与金属钠发生反应的是_________(填序号),与⑧互为同分异构体的是___________(填序号),⑤与酸性高锰酸钾反应的产物是______________(填结构简式);
(二)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
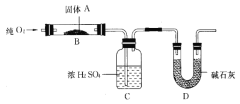
取17.1g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(4)D装置的作用是____________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________;
(5)装置改进后进行实验,若A的摩尔质量为342g/mol,C装置增重9.9g,D装置增重26.4 g,则A的分子式为_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化①大气固氮②硝酸分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.③①②B.②①③C.③②①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体中原子间通过______________________作用形成面心立方密堆积,其中M原子的配位数____________。
(2)元素Y的含氧酸中,酸性最强的是________________(写化学式),该酸根离子的立体构型为______________________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
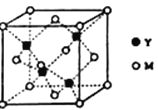
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为__________________________g·cm–3。(只写出计算式,阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com