
【题目】有机物 W 在工业上常用作溶剂和香料,其合成方法如下:
![]()
下列说法正确的是
A.N、W 互为同系物B.M 的二氯代物有 8 种结构
C.N 不可能所有原子共平面D.M、N、W 均能发生加成和取代反应
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗的值, 已知HCl气体的质量为3.65g
(1)HCl的物质的量为_______________
(2)HCl的分子个数为_______________
(3)原子总数为 _______________
(4)在标准状况的体积为________________
(5)所含电子数为 _________________
(6)如把 HCl完全溶于水配置成1L 溶液,该溶液中H+的物质的量浓度为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI与Cu(NO3)2的反应,进行实验一:
实验一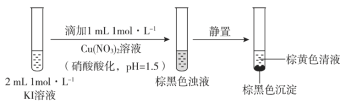
注:本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验:向2mL1mol·L-1KI溶液中加入1mL______溶液(硝酸酸化,pH=1.5),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论:实验一中生成I2的原因是酸性条件下,![]() 氧化了I-。
氧化了I-。
②乙同学认为仅由甲的实验还不能得出相应结论。他的理由是该实验没有排除____________氧化I-的可能性。
③若要确证实验一中是![]() 氧化了I-,应在实验一的基础上进行检验______的实验。
氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知:CuI为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2b._________吸附I2。为证明上述假设是否成立,取棕黑色沉淀进行实验二:
实验二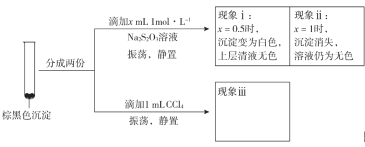
已知:CuI难溶于CCl4;I2+![]() ==2I-+
==2I-+![]() (无色);Cu++S2O32-==
(无色);Cu++S2O32-==![]() (无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
(无色)。由实验二得出结论:棕黑色沉淀是CuI吸附I2形成的。
②现象iii为______________。
③用化学平衡移动原理解释产生现象ii的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇结构式如图所示,“箭头”表示乙醇发生化学反应时分子中可能断键的位置,下列叙述中不正确的是( )
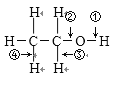
A. 与钠反应时断裂①键B. 发生消去反应时断裂②④键
C. 与乙酸发生酯化反应时断裂②键D. 发生催化氧化反应时断裂①③键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
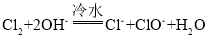 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
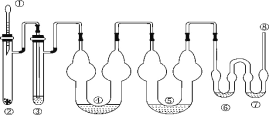
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
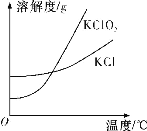
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烃A在同温、同压下蒸气的密度是H2的35倍,其分子式为________。
(2)3—甲基—1一丁炔的结构简式为________
(3)![]() 的分子式为__________
的分子式为__________
(4)分子式为C8H10属于芳香烃的同分异构体共有______种,其中_______(结构简式)在苯环上的一氯取代产物有两种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2 = 2AB的能量变化如图所示,则下列说法正确的是
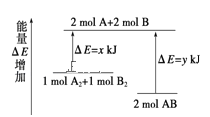
A.该反应是吸热反应
B.断裂 1molA-A 键和 1molB-B 键能放出xkJ 的能量
C.2mol AB 的总能量高于1mol A2和1mol B2和的总能量
D.断裂 2mol A-B 键需要吸收ykJ 的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粮食仓储常用磷化铝(A1P)熏蒸杀虫,A1P遇水即产生强还原性的PH3气体。国家标准规定粮食中磷物(以PH3计)的残留量不超过0.05 mgkg-1时为合格。某小组同学用如图所示实验装置和原理测定某粮食样品中碟化物的残留量。C中加入100 g原粮,E 中加入20.00mL2.50×lO-4molL-1KMnO4溶液的H2SO4酸化),C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中的溶液。
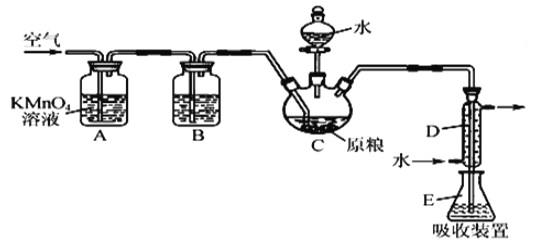
(1)装置A中的KMn04溶液的作用是_____。
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,则测得的磷化物的残留量___(填“偏髙”“偏低”或“不变”)。
(3)装置E中PH3氧化成磷酸,MnO4-被还原为Mn2+,写出该反应的离子方程式:__________。
(4)收集装置E中的吸收液,加水稀释至250 mL,量取其中的25.00 mL于锥形瓶中, 用4.0×lO-5molL-1的Na2SO3标准溶液滴定,消耗Na2SO3标准溶液20.00mL,反应原理是 S02-+Mn04-+H+→S042-+Mn2++H20(未配平)通过计算判断该样品是否合格(写出计算过程)_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com