
【题目】化学反应A2+B2 = 2AB的能量变化如图所示,则下列说法正确的是
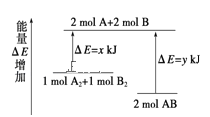
A.该反应是吸热反应
B.断裂 1molA-A 键和 1molB-B 键能放出xkJ 的能量
C.2mol AB 的总能量高于1mol A2和1mol B2和的总能量
D.断裂 2mol A-B 键需要吸收ykJ 的能量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是
A. NaHCO3:NaHCO3![]() HCO3-+ Na+
HCO3-+ Na+
B. NaHSO4:NaHSO4=Na+ +HSO4-
C. CH3COONH4:CH3COONH4=NH4++CH3COO-
D. Fe(OH)3:Fe(OH)3![]() Fe(OH)2++2OH-
Fe(OH)2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 W 在工业上常用作溶剂和香料,其合成方法如下:
![]()
下列说法正确的是
A.N、W 互为同系物B.M 的二氯代物有 8 种结构
C.N 不可能所有原子共平面D.M、N、W 均能发生加成和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族, D、E同周期。A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18。F是其所在周期中最活泼的金属元素。根据推断回答下列问题:
(1)A在周期表中的位置_____;写出A单质的电子式________。
(2)用“>”或“<”填空:
离子半径 | 非金属性 | 酸性 | 氢化物的稳定性 |
F+_D2— | A_B | D的最高价氧化物的水化物___E的最高价氧化物的水化物 | C的氢化物__E的氢化物 |
(3)—定条件,在水溶液中1molE-、![]() (x=1,2,3,4)的能量(KJ)相对大小如图所示。
(x=1,2,3,4)的能量(KJ)相对大小如图所示。
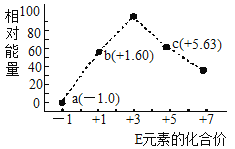
①c点对应的微粒是_______(填离子符号)。
②b→a+c反应的离子方程式为________,该反应是______反应(填“吸热”或“放热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
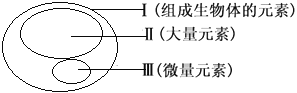
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次递增的五种常见元素。A、B元素组成的气态化合物M的水溶液呈碱性,C元素是地壳中含量最多的元素,D的单质在C的单质中燃烧后的产物可以使品红溶液褪色,E是金属元素。
(1)写出A、C两种元素组成的化合物A2C2的电子式_______。
(2)若将E金属投入盐酸中,生成了浅绿色溶液N。则N的酸性溶液与A2C2反应的离子方程式为______________________________________。
(3)R是B的氧化物,通常情况下呈红棕色。现有一试管R,欲使元素B全部转化为它的最高价氧化物对应的水化物,故进行如下实验操作:将盛有R的试管倒扣在水槽中,______。
(4)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式_____________,放电时,溶液中的H+移向_________(填正极或负极)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.氯化铝溶液和过量氨水生成氢氧化铝
B.镁在二氧化碳中燃烧生成碳酸镁
C.向苯酚溶液中滴入Na2CO3溶液,产生气泡
D.铁与高温水蒸气反应生成氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“测定1mol气体体积”的实验中,我们通常选择的测量气体是氢气,反应是镁和稀硫酸反应。图中的A、B、C三部分能组成气体摩尔体积测定装置:

(1)C装置的名称是___________________。
(2)A、B、C装置接口的连续顺序是_________________。
(3)该装置正确连接后怎样做气密性检查?_________________。
(4)本实验中有两次针筒抽气,需要记录的是第____次抽出气体的体积。
(5)下表是某同学记录的实验数据:温度:25℃,气压:101.3kPa
实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
1 | 0.115 | 10.0 | 124.8 | 7.0 |
2 | 0.110 | 10.0 | 120.7 | 6.2 |
计算两次实验1mol氢气的体积的平均值=____L(保留一位小数,镁的相对原子质量为24.3)。
(6)已知实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=____%(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com