
【题目】化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示: 
(1)该图中有两处仪器未画出,它们是、 .
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol) .
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2 , 中和后生成溶液的比热容c=4.08J/(g℃).则中和热△H=(取小数点后一位).
(4)有关中和热测定实验,下列说法错误的是 a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
【答案】
(1)泡沫塑料板(硬纸板);环形玻璃搅拌棒
(2)![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol
(3)﹣52.2kJ/mol
(4)bc
【解析】解:(1)为减少热量的散失,需增加泡沫塑料板(硬纸板),在中和反应过程中需用环形玻璃搅拌棒, 故答案为:泡沫塑料板(硬纸板);环形玻璃搅拌棒;(2)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,稀硫酸和稀氢氧化钠溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol,
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol,
故答案为: ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)= ![]() Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;3)4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2次数据无效,其余3次温度差平均值
Na2SO4(aq)+H2O(l)△H=﹣57.3kJ/mol;3)4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2次数据无效,其余3次温度差平均值 ![]() ℃=4.0℃,
℃=4.0℃,
55mL0.50mol/L氢氧化钠与25mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.025L×0.50mol/L×2=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.08J/(g℃)×4.0℃=1305.6J,即1.3056KJ,所以实验测得的中和热△H=﹣ ![]() =﹣52.2kJ/mol,
=﹣52.2kJ/mol,
故答案为:﹣52.2kJ/mol;(4)a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度,由于温度计上会有氢氧化钠,氢氧化钠与硫酸反应放热,导致硫酸的起始温度偏高,那么试验后温度增加量就比实际要小,导致中和热数值比57.3低,故a正确;
b.温度计的冲洗液不能倒入小烧杯参与反应,否则会使整个溶液的质量增大,温度上升的值减小,使测得的中和热数值偏小,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则容易是热量损坏,测定结果偏小,故c错误;
d.若装置完全相同,操作均没失误,试剂用量加倍,中和放出的热量加倍,但中和热不变,由于这个实验的关键是减少热量的散失,当实验放出的热越多,散失的那部分相对于总热量就越小,则误差越小,故d正确;
故答案为:bc.
(1)由图可知缺少泡沫塑料板(硬纸板)、环形玻璃搅拌棒;(2)中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;(3)先判断温度差的有效性,然后求出温度差平均值,根据Q=mc△T计算;(4)a.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高;
b.温度计的冲洗液不能倒入小烧杯参与反应;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中;
d.试剂用量加倍,中和放出的热量加倍,但中和热不变,有利于减小实验误差.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气: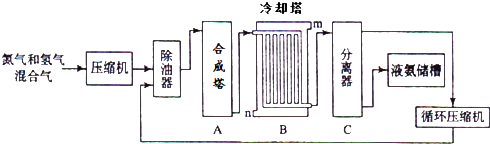
(1)原料气之一氮气的工业制取方法是 , 写出氨气的工业用途(任答一点) .
(2)写出合成塔中发生的反应的化学反应方程式 .
在冷却塔中对混合气体进行冷却,冷水的入口(答m或n).
(3)设备C的作用 .
其分离器中的过程对整个工业合成氨的意义 . (试结合平衡移动原理回答)
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g)CO2(g)+H2(g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于(精确到小数点后一位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.升高体系的温度或增加某一组分的浓度均能增加反应体系中活化分子所占百分数
B.H2+Cl2 ![]() 2HCl反应中化学能只转变为热能
2HCl反应中化学能只转变为热能
C.面粉生产工厂要求严禁烟火是因为面粉有机物颗粒极小,总表面积巨大容易被引燃爆炸
D.高锰酸钾受热分解是一个熵减小的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A. 气体摩尔体积约为22.4L/mol
B. 2 mol N2O和2 mol NO2含原子数相同
C. 等质量的O2和O3中所含氧原子个数相同
D. 等物质的量的CO和CO2中所含碳原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( ) 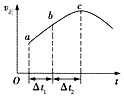
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质随原子序数的递增呈周期性变化的实质是( )
A. 元素的相对原子质量增大,量变引起质变
B. 原子的电子层数增多
C. 原子核外电子排布呈周期性变化
D. 原子半径呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )
A.C(s)+ ![]() O2(g)═CO(g)△H=+110.5 kJ?mol﹣1
O2(g)═CO(g)△H=+110.5 kJ?mol﹣1
B.C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ?mol﹣1
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ?mol﹣1
D.H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8 kJ?mol﹣1
O2(g)═H2O(g)△H=﹣241.8 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与1 mol·L-1 H2SO4反应制取氢气时,下列措施不能使氢气生成速率加快的是
A. 加入少量的CuSO4溶液B. 改用18 mol·L-1硫酸溶液反应
C. 不用铁片,改用铁粉D. 加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质的量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( ) 
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2 与丙中N2O4 的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com