
 .
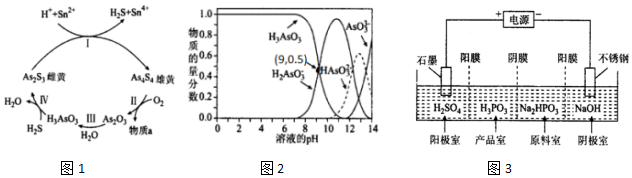
.分析 (1)①H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键;
②雄黄在空气中加热至300℃时会 两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),依据原子守恒可知另一种氧化物为二氧化硫,过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式;
(2)①根据图象结合pH分析;
②A.n(H3AsO3):n(H2AsO3-)=1:1时,溶液的pH=9;
B.依据图象中H3AsO3和H2AsO3-浓度相同时的PH=9;
C.pH=12时,溶液显碱性;
D.在K3AsO3溶液中,存在三步水解,以第一步水解为主;
③将KOH 溶液滴入亚砷酸溶液,当pH 调至11时,亚砷酸与氢氧根离子反应生成H2AsO3-;
(3)①产品室中HPO32-和氢离子结合 生成亚磷酸;
②阴极上得电子发生还原反应,电极反应式为2H++2e-=H2↑;
解答 解:(1)①H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,
,
故答案为: ;
;
②雄黄在空气中加热至300℃时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为:As4S4+7O2$\frac{\underline{\;300℃\;}}{\;}$2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式为2H2O2+H2O+As2O3=2H3AsO4,
故答案为:SO2;2H2O2+H2O+As2O3=2H3AsO4;
(2)①由图象可知,pH在7.35-7.45之间,溶液中含砷元素的主要微粒是H3AsO3;
故答案为:H3AsO3;
②A.n(H3AsO3):n(H2AsO3-)=1:1时,溶液的pH=9,所以溶液显碱性,故A正确;
B.依据图象中H3AsO3和H2AsO3-浓度相同时的pH=9,H3AsO3?H++H2AsO3-,K=$\frac{c({H}^{+})c({H}_{2}As{{O}_{3}}^{-})}{c({H}_{3}As{O}_{3})}$=c(H+)=10-9mol/L,故B错误;
C.pH=12时,溶液显碱性,则c(OH-)>c(H+),所以c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)>c(H+),故C错误;
D.在K3AsO3溶液中,存在三步水解,以第一步水解为主,第一步水解生成HAsO32-,第二步水解生成H2AsO3-,则c(AsO33-)>c(HAsO32-)>c(H2AsO3-),故D正确;
故答案为:BC;
③将KOH 溶液滴入亚砷酸溶液,当pH 调至11时,亚砷酸与氢氧根离子反应生成H2AsO3-,其反应的离子方程为:H3AsO3+OH-=H2AsO3-+H2O;
故答案为:H3AsO3+OH-=H2AsO3-+H2O;
(3)①产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,
故答案为:HPO32-+2H+=H3PO3;
②得到1mol亚磷酸的同时,阴极室制得2molNaOH,得NaOH质量为80g,
故答案为:80.
点评 本题考查较为综合,主要是水解反应、氧化还原反应、电极反应式的书写等知识点,有关平衡常数的计算等,侧重分析与应用能力的考查,注意守恒法应用,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
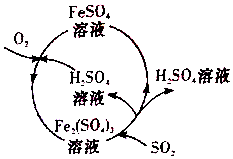 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
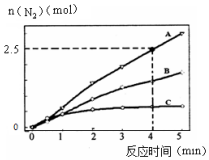 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,1 L 0.50 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH+4物质的量不同 | |
| B. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| D. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁溶液与足量的烧碱溶液反应 2OH-+Mg2++2HCO3-=MgCO3↓+CO32-+2H2Of | |
| B. | 氯化铵溶液与澄清石灰水反应 NH4++OH-=NH3↑+H2O7 | |
| C. | 碘化亚铁与溴水反应 2I-+Br2=I2+2Br- | |
| D. | 向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO2-+H++H2O═Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com