
| A. | 碳酸氢镁溶液与足量的烧碱溶液反应 2OH-+Mg2++2HCO3-=MgCO3↓+CO32-+2H2Of | |
| B. | 氯化铵溶液与澄清石灰水反应 NH4++OH-=NH3↑+H2O7 | |
| C. | 碘化亚铁与溴水反应 2I-+Br2=I2+2Br- | |
| D. | 向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO2-+H++H2O═Al(OH)3↓ |
分析 A.氢氧化钠足量,反应生成氢氧化镁沉淀、碳酸钠和水,不会生成碳酸镁;
B.二者在不加热时反应生成的是一水合氨按;
C.若溴水足量时,亚铁离子也被氧化;
D.硫酸氢钠少量,反应生成氢氧化铝沉淀.
解答 解:A.碳酸氢镁溶液与足量的烧碱溶液反应,氢氧化镁更难溶,反应生成的是氢氧化镁沉淀,正确的离子方程式为:4OH-+Mg2++2HCO3-=Mg(OH)2↓+2CO32-+2H2O,故A错误;
B.氯化铵溶液与澄清石灰水反应生成氯化钙和一水合氨按,正确的离子方程式为:NH4++OH-=NH3↑•H2O,故B错误;
C.碘化亚铁与溴水反应,若溴水少量时发生反应:2I-+Br2=I2+2Br-,但是溴水足量时亚铁离子也被氧化,发生反应为:2Fe2++4I-+3Br2=I2+2Fe3++6Br-,故C错误;
D.向偏铝酸钠溶液中加入少量的NaHSO4溶液,反应生成硫酸钠和氢氧化铝沉淀,反应的离子方程式为:AlO2-+H++H2O═Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题
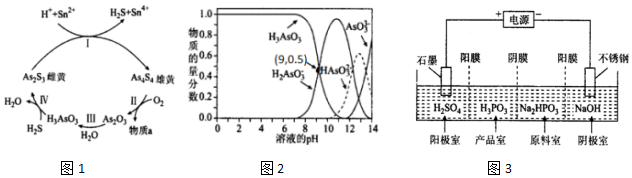
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
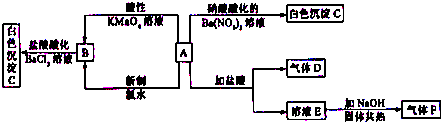
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | KSCN溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com