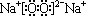A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )
A.分子晶体,是一种弱电解质
B.离子晶体,是一种强电解质
C.是一种合金
D.原子晶体,是一种非电解质
【答案】分析:A原子最外层电子数为a,次外层电子数为b;最外层电子数小于等于8,所以a大于0,小于8或等于8;次外层为K层或L层,所以b为2或8.B元素原子M层电子数为a-b,L层电子数为a+b,所以8≥a-b>0.a+b=8,
则有:0<a≤8,a-b>0,a+b=8,8≥a-b>0,b=2或8,
所以a、b分别为:a=6,b=2,
所以A的原子核外有8(2+6=8)个电子,是O元素;
B的原子核外有14(2+8+4=14)个电子,是Si元素.
形成的化合物为SiO2,为原子晶体.
解答:解:A原子最外层电子数为a,次外层电子数为b;最外层电子数小于等于8,所以a大于0,小于8或等于8;次外层为K层或L层,所以b为2或8.B元素原子M层电子数为a-b,L层电子数为a+b,所以8≥a-b>0.a+b=8,
则有:0<a≤8,a-b>0,a+b=8,8≥a-b>0,b=2或8,
所以a、b分别为:a=6,b=2,
所以A的原子核外有8(2+6=8)个电子,是O元素;
B的原子核外有14(2+8+4=14)个电子,是Si元素.
形成的化合物为SiO2,具有很高的熔沸点,硬度大,应为原子晶体,熔融状态下不导电,不溶于水,和水不反应,为非电解质,
故选D.
点评:本题考查元素的推断以及对应化合物的性质,题目难度中等,本题注意把握原子核外电子排布特点.



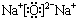 或
或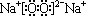
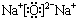 或
或