
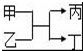
 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 钠和氢气 | B. | 硫和氧 | C. | 碳和硅 | D. | 氯气和溴单质 |
分析 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,该反应为置换反应,钠能和水或酸反应生成氢气、碳和二氧化硅反应生成Si单质,溴属于长周期元素,据此分析解答.
解答 解:若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,该反应为置换反应,钠能和水或酸反应生成氢气2Na+2HCl=2NaCl+H2↑、碳和二氧化硅反应生成Si单质2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO,且Na和H、C和Si都属于同一主族短周期元素,甲为Na或C,丙为HCl或SiO2符合条件,A不符合,C符合,硫和氧是氧气可以置换硫、溴属于长周期元素,BD不符合条件,
故选C.
点评 本题以元素化合物知识为载体考查置换反应及元素周期表结构等知识点,明确物质的性质是解本题关键,注意C能置换出Si单质,但生成CO而不是二氧化碳,为易错点,题目难度中等.


科目:高中化学 来源: 题型:推断题
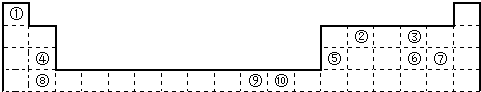
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | 2 +Br2$\stackrel{FeBr_{3}}{→}$2 +Br2$\stackrel{FeBr_{3}}{→}$2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
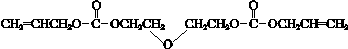
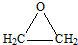 .
.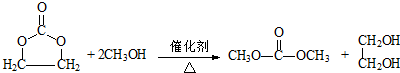 .
.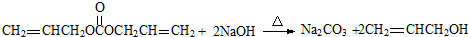 .
.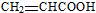 .
. .
.| a.能与乙酸发生酯化反应 | b.能与乙醇发生酯化反应 |
| c.1mol C最多能与2mol Na反应 | d.C的同分异构体不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| B. | 1mol Cl2参加反应,转移电子数一定为2NA | |
| C. | 标准状况下,2.24 L氯仿(CHCl3)中含有C-Cl数目为0.3NA | |
| D. | 0.5 mol O3与11.2 LO2所含的分子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com