
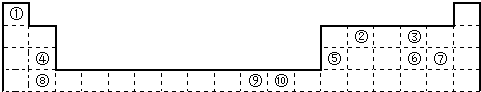
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
分析 由元素周期表可以得出元素①为H,②为C,③为O,④为Mg,⑤为Mn,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu;
(1)⑥所在周期为第三周期,Cl的非金属性最强;
(2)⑩元素的价电子为3d104s1;
(3)⑩的常见阳离子的最外层为第三层,共18个电子;
(4)⑦基态原子中能量最高为最外层p电子,为哑铃型;
(5)氢化物的产量作为衡量石油化工发展水平的标志,该氢化物为乙烯,含碳碳双键、C-H键;
(6)表格中D、E、F的I1与I2差别较大,易失去电子,B比A和C的第一电离能都略大,可能B中最外层为半满稳定结构.
解答 解:由元素周期表可以得出元素①为H,②为C,③为O,④为Mg,⑤为Mn,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu;
(1)⑥所在周期为第三周期,Cl的非金属性最强,则电负性最大的为F,故答案为:Cl;
(2)⑩元素的价电子为3d104s1,则⑩元素在ds区,故答案为:ds;
(3)⑩的常见阳离子的最外层为第三层,共18个电子,最外层电子排布为3s23p63d10,故答案为:3s23p63d10;
(4)⑦为Cl,基态原子中能量最高为最外层3p电子,电子云形状为哑铃型,故答案为:3p;哑铃;
(5)氢化物的产量作为衡量石油化工发展水平的标志,该氢化物为乙烯,含碳碳双键、C-H键,则
A.分子中不含氢键,故A错误;
B.属于含有C-H极性键的非极性分子,故B正确;
C.单键为σ键,双键中含1个σ键,则含有4个sp2-s的σ键和1个p-p的π键、1个p-p的σ键,故C错误;
D.该氢化物分子中②原子上没有孤对电子,成键数为3,C原子采用sp2杂化,故D正确;
故答案为:BD;
(6)表格中D、E、F的I1与I2差别较大,易失去电子,表中的金属元素是DEF,B比A和C的第一电离能都略大,原因为B元素的np轨道上的电子半充满,自身更稳定,所以第一电离能比A、C大,
故答案为:DEF;B元素的np轨道上的电子半充满,自身更稳定,所以第一电离能比A、C大.
点评 本题考查位置、结构与性质及原子结构与元素周期律,为高频考点,把握原子结构、化学键、电负性及电离能等为解答的关键,侧重分析与应用能力的考查,注意表格数据及周期表的应用,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6、C4H4O2 | B. | C3H8、C4H6O | C. | CH4O、C3H4O5 | D. | C2H2、C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X<Y<Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序增强 | |
| D. | 元素的最低负价的绝对值按X、Y、Z顺序增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用如图装置由氯化镁溶液制取无水氯化镁晶体 | |
| B. | 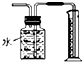 用如图所示装置测量Cu与浓硝酸反应生成气体的体积 | |
| C. | 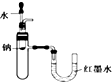 用如图所示装置验证Na和水反应的热效应 | |
| D. | 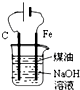 用如图装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
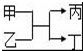 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 钠和氢气 | B. | 硫和氧 | C. | 碳和硅 | D. | 氯气和溴单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com